
判断正误,正确的划“√”,错误的划“×”
(1)1 mol KHSO4加热熔化可电离出2NA阳离子( )
(2)共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏( )
(3)共价化合物熔点都低于离子化合物( )
(4)分子内共价键越强,分子越稳定,其熔、沸点也越高( )
(5)含有阳离子的化合物一定含有阴离子( )
(6)含有离子键的物质不可能是单质( )
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A.食醋中含有乙酸,乙酸可由乙醇氧化得到
B.乙醇、乙酸乙酯、乙酸能用饱和碳酸钠溶液鉴别
C.乙酸、乙酸乙酯、葡萄糖和淀粉的最简式相同
D.生活中食用的食醋、植物油、动物蛋白等都是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要22.4 L(标准状况)SO2气体。化学小组同学依据化学方程式Zn+2H2SO4(浓)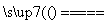 ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
ZnSO4+SO2↑+2H2O计算后,取65.0 g锌粒与98%的浓H2SO4(ρ=1.84 g·cm-3)110 mL充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式)。产生这种结果的主要原因是________(用化学方程式和必要的文字加以说明)。
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
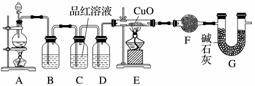
①装置B中加入的试剂为________,作用是________。
②装置D加入的试剂为________________,装置F加入的试剂为________________。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是________。
④U形管G的作用为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知正己烷的球棍模型为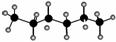 。某有机物a的分子式和正己烷相同,且主链上有4个碳原子,则下列关于a的观点正确的是 ( )。
。某有机物a的分子式和正己烷相同,且主链上有4个碳原子,则下列关于a的观点正确的是 ( )。
A.a分子中可能有三个甲基
B.a的分子式为C6H10
C.a的一氯代物可能有三种
D.在光照条件下,a能与溴的四氯化碳溶液发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”
(1)形成离子键的阴、阳离子间只存在静电吸引力( )
(2)全部由非金属元素形成的化合物一定是共价化合物( )
(3)某些金属与非金属原子间能形成共价键( )
(4)某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键( )
(5)在水溶液中能导电的化合物一定是离子化合物( )
(6)离子化合物在任何状态下都能导电( )
(7)含有离子键的化合物中,一个阴离子可同时与几个阳离子形成静电作用( )
查看答案和解析>>
科目:高中化学 来源: 题型:
判断正误,正确的划“√”,错误的划“×”。
(1)离子晶体除含离子键外,一定不含其他化学键(×)
(2)离子晶体中一定含有金属阳离子(×)
(3)离子晶体的熔点一定低于原子晶体(×)
(4)含有阳离子的晶体一定是离子晶体(×)
(5)离子晶体中一定不含分子(×)
(6)金属与非金属形成的化合物一定都是离子化合物(×)
(7)具有金属光泽且能导电的单质一定是金属(×)
(8)金属晶体的熔点差别很大,有的很高(如钨),有的很低(如汞)(√)
查看答案和解析>>
科目:高中化学 来源: 题型:
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是______周期第______族,其单质可采用电解熔融__________的方法制备。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是__________,碱性最强的是______________。(填化学式)
(3)气体分子(mn)2的电子式为__________。(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
依据下列甲、乙、丙三图,判断下列叙述不正确的是( )
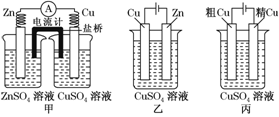
A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解
D.乙、丙装置中,c(Cu2+)基本不变
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,体积为1 L的密闭容器中发生如下反应:
SiF4(g)+2H2O(g)SiO2(s)+4HF(g)
ΔH=148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是__________(填字母)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:__________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填字母)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com