
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源:贵州省凯里一中2009届第二轮限时训练理综化学(3) 题型:058
甲、乙、丙三位同学分别进行“Na2CO3和NaCl混合物中Na2CO3质量分数测定”的实验:
(1)甲同学实验的主要步骤有:①过滤 ②加入足量的CaCl2溶液 ③将沉淀小心烘干、称量,测得固体质量为ng ④称取mg样品溶于适量蒸馏水 ⑤洗涤沉淀2-3次.该同学正确的操作步骤为________(填序号);混合物中碳酸钠的质量分数为________(只需列出计算式).
(2)乙同学把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,实验室中只有如下试剂:样品、6 mol/L盐酸、Na2CO3溶液、CaCl2溶液、饱和NaHCO3溶液.回答下列问题:
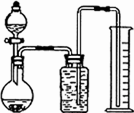
①广口瓶中盛放的溶液是________.
②该装置测定的气体体积往往不准确(不考虑导管中水的体积),理由是________________________
(3)丙同学准确称取w g固体混合物放入锥形瓶中,加入V1 mL 0.1000 mol/L盐酸,充分反应,用0.1000 mol/L的氢氧化钠溶液滴定过量盐酸,消耗氢氧化钠溶液V2 mL.请回答下列问题:
①实验室现有1.000 mol/L盐酸溶液.为了精确配制10 mL 0.1000 mol/L的盐酸溶液,需要的仪器有:烧杯、100 mL容量瓶、玻璃棒、________.
②滴定时选择________作指示剂,滴定终点溶液的颜色变化为________.
③混合物中碳酸钠的质量分数为________(只需列出计算式).
查看答案和解析>>
科目:高中化学 来源: 题型:

图2-27
有关反应的化学计量关系为:
①A与B按物质的量之比n(A)/n(B)=1/2完全反应生成G
②B与C按物质的量之比n(B)/n(C)=3/1完全反应生成F
③C与D按物质的量之比n(C)/n(D)=1/3完全反应生成E
请填空:
(1)构成上述物质各元素的离子中,电子层结构相同且按其离子半径由大到小排列的顺序是(用离子符号表示)_______________。
(2)物质G的电子式是____________,其化学键类型是____________。
(3)B和C反应生成F的化学方程式为______________________________________________。
(4)实验室中制取E反应的化学方程式为___________________________________,干燥E时常用干燥剂的名称是____________。
(5)常温下将F投入J中可生成E和一种白色难溶物X,该反应的化学方程式为______________________________________________;若将I通入J中可生成H和某物质Y,X与Y溶液可发生中和反应,该反应的离子方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
图2-27为短周期元素组成的中学常见A—J 10种物质的转换关系。已知A、B、C、D均为单质,通常状况下只有A、C、D为气态。它们在一定条件下发生图示化学反应,得到E—J等化合物(图中物质的状态均为常温常压下)。

图2-27
有关反应的化学计量关系为:
①A与B按物质的量之比n(A)/n(B)=1/2完全反应生成G
②B与C按物质的量之比n(B)/n(C)=3/1完全反应生成F
③C与D按物质的量之比n(C)/n(D)=1/3完全反应生成E
请填空:
(1)构成上述物质各元素的离子中,电子层结构相同且按其离子半径由大到小排列的顺序是(用离子符号表示)_______________。
(2)物质G的电子式是____________,其化学键类型是____________。
(3)B和C反应生成F的化学方程式为______________________________________________。
(4)实验室中制取E反应的化学方程式为____________________________________________,干燥E时常用干燥剂的名称是____________。
(5)常温下将F投入J中可生成E和一种白色难溶物X,该反应的化学方程式为
______________________________________________;若将I通入J中可生成H和某物质Y,X与Y溶液可发生中和反应,该反应的离子方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省三校高三上学期12月联考理综化学试卷(解析版) 题型:填空题
六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主成分为SrSO4)为原料制备,生产流程如下:

(1)第①步反应前天青石先研磨粉碎,其目的是________________。
第③步加入适量稀硫酸的目的是______ _。
(2)第①步反应若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:________________________________________。
(3)第④步操作依次是蒸发浓缩、冷却结晶、过滤、________、_______。
(4)称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(产品中不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的KSCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。若滴定过程用去上述浓度的KSCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为________(保留4位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com