
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | Fe2O3 | SiO2 | NaOH | 过滤 |
| B | CO2 | CO | O2 | 点燃 |
| C | FeCl2溶液 | FeCl3 | Cu | 分液 |
| D | CH3CH2OH | H2O | Na | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水将苯、乙酸、四氯化碳区分开来 | |
| B. | 在实验室中通常将钠保存在汽油里 | |
| C. | 用稀硝酸洗去残留在试管壁上的银 | |
| D. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
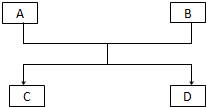 已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如图所示,请按要求写出有关反应式,是离子反应的只写离子方程式.
已知A、B、C、D的组成元素都属于短周期元素,其中A、D为单质,B、C为化合物,它们之间的关系转化如图所示,请按要求写出有关反应式,是离子反应的只写离子方程式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | 20~40mg•kg-1 |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 | |
| D. | 打开啤酒瓶盖后产生大量的气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
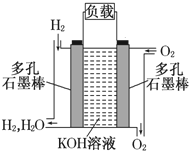 如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:
如图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从两极通入燃料电池时,便可在闭合回路中不断地产生电流.这被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高率的特点.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com