
(本题共14分)氨在工业生产中有广泛的用途。
54.某工厂平均每天产生约600 m3废氨水(该氨水浓度为153 mg/L,密度为1 g/cm3),该废氨水中氨的物质的量浓度为_____________。
55.若含0.800 mol NH3的某氨水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,析出晶体后过滤,得到滤液31.2g,则NH4HCO3的产率为_______%。(保留1位小数)
56.NH3常用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
57.硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时得到副产品氮肥。已知吸收尾气后的氨水全部转化为铵盐。取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16mol NH3,同时得到21.86g沉淀。通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比。
54.9×10-3 mol·L-1 (3分) ;55.91.8 (3分) ;56.0.14 (3分)
57.(5分)NH4)2SO3、NH4HSO3、(NH4)2SO4。它们的物质的量的比是5 : 4 : 1。
【解析】
试题分析:54.该废氨水中氨的物质的量浓度C= ;
;
55.若含0.800 mol NH3的某氨水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,若NH3中的N元素完全转化为NH4HCO3,则需要CO2的物质的量是0.800mol,理论产量是0.800mol×79g/mol=63.2g,实际产量是0.800mol×44g/mol+54.0 g-31.2g=58g,所以NH4HCO3的产率为(58g÷63.2g)×100%=91.8%;
56.假设NH3的物质的量是1mol,则反应需要氧气的物质的量是1.25mool,由于空气中氧气的体积分数为0.20,则需要空气的物质的量是1.25mool÷0.2=6.25mol.由于气体的体积比等于它们的物质的量的比,所以氨—空气混合物中氨的体积分数为[(1mol÷(1mol+6.25mol))×100%=14%;
57. ①向该铵盐中加入硫酸产生SO2, n(SO2)=0.09mol, 说明在该铵盐中含有(NH4)2SO3、NH4HSO3中至少一种 ;加入足量Ba(OH)2,产生0.16mol NH3,n(NH3)=0.16mol;同时产生沉淀21.86g。若沉淀完全是BaSO3,其质量是0.09mol×217g/mol=19.53g<21.86g, 所以含BaSO3 和BaSO4。故原铵盐含有亚硫酸盐和硫酸盐;②n(NH3)=0.16mol﹤2n(SO2)=0.18mol,所以铵盐中含NH4HSO3.即该盐是NH4)2SO3、NH4HSO3、(NH4)2SO4的混合物;③根据元素守恒,由于n(SO2)=0.09mol ,所以n(BaSO3)=0.09mol,m(BaSO3)=217g/mol×0.09mol=19.53g,m(BaSO4)=21.86-19.53=2.33(g)。则n(BaSO4)=0.01mol= n[(NH4)2SO4],n[(NH4)2SO3]=0.16mol-0.01mol×2-0.09mol=0.05mol; n(NH4HSO3)=0.09-0.05=0.04mol.在同一溶液中溶质的物质的量的比等于浓度的比。所以c[(NH4)2SO3] : c(NH4HSO3) : c[(NH4)2SO4] = 5 : 4 : 1。
考点:考查氨的浓度的计算、性质的应用、反应产物的成分的确定和各组分的浓度的比的计算的知识。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
实验室制取氯气并回收氯化锰,能达到该实验目的的装置是

A.用装置甲制取氯气 B.用装置丙分离二氧化锰和氯化锰溶液
C.用装置乙吸收制取氯气的尾气 D.用装置丁蒸干氯化锰溶液制 MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:计算题
(本题共14分)
溴化钠是工业提溴的中间产物,也是重要的化工生产原料,回答下列问题。
56.工业上用氯气氧化卤水中的溴离子,吹出溴蒸气后用10% 的纯碱溶液吸收,反应的化学方程式为:
3Na2CO3+ 3Br2 → 5NaBr + NaBrO3 + 3CO2若生成标准状况下3.36 L CO2,吸收的Br2为________g。
57.吹出的溴蒸气中会含有少量未反应的氯气,用纯碱吸收后实际生成的是NaCl、NaBr和NaBrO3。若所得溶液中含0.1 mol NaCl与0.6 mol NaBr,则溶液中NaBrO3的物质的量为_______mol。
58.将纯碱吸收后所得的溶液浓缩,加入2 mol/L H2SO4后蒸馏可以回收纯溴:
5NaBr + NaBrO3 + 3H2SO4 → 3Na2SO4+ 3Br2↑+ 3H2O
已知向一定质量的浓缩液中加入300mL硫酸可回收81.6 g液溴,硫酸全部转化为硫酸钠。若改为加入180 mL硫酸,计算可回收的液溴的质量。
59.向0.3 mol NaBr固体中加入足量浓硫酸并微热,产生的气体呈红棕色,且残留物中不含溴元素。将所得气体通入280 mL 2 mol/L的Na2SO3溶液中,无任何气体逸出,最终得到只含NaBr、Na2SO4和NaHSO3三种溶质的无色溶液。求红棕色气体中各组分的化学式与物质的量。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为W(s) + 2I2(g) WI4(g)。下列说法正确的是
WI4(g)。下列说法正确的是
A.温度越高,灯丝的使用寿命越长
B.WI4在灯丝上分解,产生的W又沉积在灯丝上
C.WI4在灯管壁上分解,使灯管的寿命延长
D.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:选择题
“酸化”是实验中经常采用的方法,下列酸化正确的是
A.抑制Fe2+的水解,用稀硝酸酸化
B.提高高锰酸钾的氧化能力,用盐酸酸化
C.确认溶液中含有SO42—时,用盐酸酸化,再检验
D.检验氯代烃中含氯 ,加碱溶液加热后,用硫酸酸化,再检验
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:填空题
(本题共12分)大约100年前,德国化学家哈伯(F.Haber)开始研究由氮气和氢气合成氨。一种工业合成氨的简易流程图如下:

28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________________________。
29.工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化含某些杂质的原料氢气。已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27。R原子核外电子有_____种不同运动状态,最外层的p电子有_______种自旋方向。
30.常温下,不能与M单质发生反应的是_________(填序号)
A.CuSO4溶液
B.Fe2O3
C.浓硫酸
D.NaOH溶液
E.Na2CO3固体
步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g) CO(g)+3H2(g)- 206.4 kJ
CO(g)+3H2(g)- 206.4 kJ
②CO(g)+H2O(g) CO2(g)+H2(g)+ 41.2 kJ
CO2(g)+H2(g)+ 41.2 kJ
31.对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是 。
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.降低压强
32.利用反应②,将CO进一步转化,可提高H2产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO转化率为__________。
33.依据温度对合成氨反应的影响,在下图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解 释 |
A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
C | Ca(OH)2溶液能溶解难溶的杂卤石(K2SO4?MgSO4?2CaSO4?2H2O)浸出K+ | 氢氧根离子与镁离子结合,使平衡向右移动 |
D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:填空题
【化学——选修5:有机化学基础】(15分)
有机物丙(C13H18O2)是一种香料,其合成路线如图所示。其中A的相对分子质量通过质谱法测得为56,它的核磁共振氢谱显示只有两组峰;D可以发生银镜反应,在催化剂存在条件下1 mol D与2 mol H2反应可以生成乙;丙中含有两个-CH3


(1)A的结构简式为 ;乙的分子式为 。
(2)C与新制Cu(OH)2悬浊液反应的化学方程式_________________。
(3)D所含官能团的名称是 ;D有多种同分异构体,其中与其所含官能团相同的同分异构体有 种(不考虑立体异构)。
(4)甲与乙反应的化学方程式为 。
(5)写出满足下列条件的有机物的结构简式 ⅰ与乙互为同分异构体;ⅱ遇FeCl3溶液显紫色;ⅲ其苯环上的一溴代物只有两种。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第四次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法中,正确的是
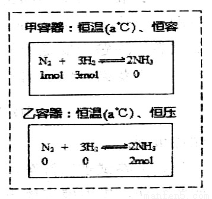
A.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
B.通过上图所示的不同途径,可建立相同的平衡,但反应过程中放出或吸收的热量可能不相等
C.C(石墨,s)=C(金刚石,s) △H> 0所以金刚石比石墨稳定
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com