
中学化学中常见的几种物质存在如图所示的转化关系。其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)
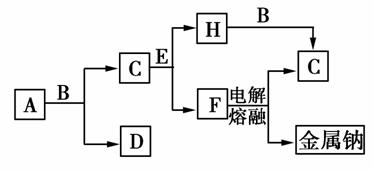
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式:________________。
(2)固体E中含有的化学键的类型是________________,C与E溶液反应的离子方程式为________________。
(3)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为________________。
(4)某课外小组的同学用E溶液吸收足量C后,利用如图所示装置向吸收液中持续通入SO2气体。
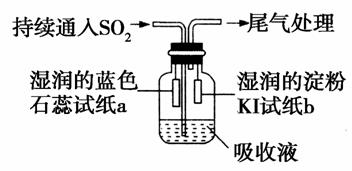
实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学认为使a变红的是_____(写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因:________________。
③最终试纸b褪色,同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO ,从而使蓝色消失;二是________________。
,从而使蓝色消失;二是________________。
解析:本题主要考查了物质的推断、化学键、离子反应、实验探究等,意在考查考生综合分析问题的能力及实验探究能力。结合框图和题中已知信息可推知,A、B、C、D、E、F、H分别为MnO2、HCl、Cl2、MnCl2、NaOH、NaCl、NaClO。(3)根据题意可知,Cl-和ClO-在酸性条件下可发生归中反应生成Cl2。(4)①因向吸收液中持续通入SO2,过量的SO2溶于湿润的试纸a上,与水发生反应生成的H2SO3具有酸性。②黄绿色气体为Cl2,Cl2可将I-氧化成I2,I2遇淀粉变蓝色。③因向吸收液中持续通入SO2,SO2具有较强的还原性,能将I2还原为I-。
答案:(1)MnO2+4HCl(浓)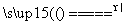 MnCl2+Cl2↑+2H2O(2分)
MnCl2+Cl2↑+2H2O(2分)
(2)离子键、极性共价键(2分,答对一种给1分) Cl2+2OH-===Cl-+ClO-+H2O(1分)
(3)ClO-+Cl-+2H+===Cl2↑+H2O(2分)
(4)①SO2(或H2SO3)(1分) ②Cl2+2I-===2Cl-+I2(1分) ③I2有氧化性,SO2能将I2还原成I-,从而使蓝色消失(1分)


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列转化不属于煤或石油的综合利用的是 ( )
A.将煤干馏制得煤焦油和焦炭
B. 在一定条件下将煤与氢气转化为液体燃料
C. 将煤变为煤饼作燃料
D.将石油裂解制得乙烯等化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO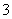 中的两种组成,可以发生如图转化,下列说法正确的是( )
中的两种组成,可以发生如图转化,下列说法正确的是( )
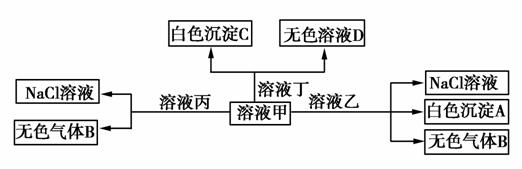
A.甲为AlCl3,乙为NaHCO3
B.溶液丙中还可以大量共存的离子有Fe2+、NO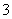 、SO
、SO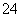
C.在甲中滴加丁开始反应的离子方程式:HCO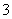 +Ba2++OH-===BaCO3↓+H2O
+Ba2++OH-===BaCO3↓+H2O
D.白色沉淀A可能溶解在溶液D中
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置进行实验,下列对实验现象的解释不合理的是( )

| 选项 | ①中试剂 | ①中现象 | 解释 |
| A | Ba(NO3)2溶液 | 生成白色沉淀 | SO |
| B | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
| C | 紫色石蕊溶液 | 溶液变红 | SO2与水反应生成酸 |
| D | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的应用与性质相对应的是( )
A.氢氟酸可用于雕刻玻璃是因为其具有酸性
B.SO2可用作漂白剂是因为其具有还原性
C.浓硫酸可用作干燥剂是因为其具有强氧化性
D.氯化铁溶液可用于制作印刷电路板是因为其能氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象中,由于发生取代反应而引起的是( )
A.乙烯通入溴的四氯化碳溶液中,溶液褪色
B.甲烷和氯气的混合气体在光照后,瓶壁上有油状液滴附着
C.苯滴加到溴水中,振荡后水层接近无色
D.将灼热的铜丝迅速插入乙醇中,反复多次,有刺激性气味产生
查看答案和解析>>
科目:高中化学 来源: 题型:
用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为( )
A.1 mol·L-1 B.2 mol·L-1C.3 mol·L-1 D.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中化合物的性质比较,不正确的是
A.酸性:HClO4>HBrO4>HIO4
B.稳定性:PH3>H2S>HCl
C.碱性:NaOH>Mg(OH)2>Al(OH)3
D.非金属性:F>O>S
查看答案和解析>>
科目:高中化学 来源: 题型:
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)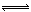 NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
NaNO3(s)+ClNO(g) K1 ∆H < 0 (I)
2NO(g)+Cl2(g)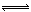 2ClNO(g) K2 ∆H < 0 (II)
2ClNO(g) K2 ∆H < 0 (II)
(1)4NO2(g)+2NaCl(s)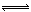 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L -1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(I
-1•min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(I I)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
I)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c (CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶 液B中加适量NaOH
液B中加适量NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com