
【题目】下列物质属于酸性氧化物的是 ( )
A.Na2OB.COC.CaOD.SO2
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案科目:高中化学 来源: 题型:
【题目】工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2) 2],反应的化学方程式为 2NH3(g)+ CO2 (g) CO(NH2) 2(l)+ H2O(l)+Q(Q>0)。该反应分两步进行:① 2NH3(g)+ CO2 (g) NH4COONH2 (s)+ Q1(Q1>0),② NH4COONH2 (s) CO(NH2) 2(l)+ H2O(l)+Q2 (Q2<0).
(1)固体CO2称干冰,属于___________晶体。氮原子最外层电子排布式是___________。
(2)氧元素的非金属性比碳强,用原子结构的知识说明理由_________________
(3)下列示意图中,能正确表示合成尿素过程中能量变化的是____________。
A、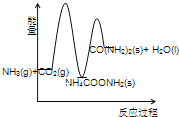 B、
B、
C、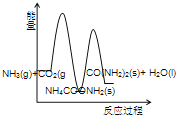 D、
D、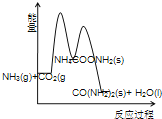
(4)写出合成尿素第一步反应的平衡常数表达式K=_________________________________。
(5)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如图所示。
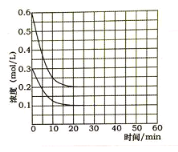
① 在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为___________。
② 为提高合成尿素的产率,下列可以采取的措施有____________。
a. 缩小反应容器的容积 b. 升高温度
c. 增加反应物的量 d. 使用合适的催化剂
③ 若保持平衡的温度和体积不变,25min 时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在下图中画出25~50min内氨气的浓度变化曲线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿(主要成分 FeS2)是工业制硫酸的主要原料,暴露在空气中会被缓慢氧化,其氧化过程如下图所示。

下列有关说法不正确的是
A. 为了验证b 溶液中含 Fe2+,可选用 KSCN 溶液和氯水
B. 氧化过程会产生较多酸性废水破坏矿区生态环境
C. 取 10mlb 溶液测定其成分,通入标准状况下Cl222.4ml 恰好完全反应。然后调节 pH,使溶液中的铁元算全部转化为沉淀,经过滤、洗涤、灼烧,冷却后称重,得固体质量为 0.32g,则溶液中 c(Fe3+)=0.2molL-1
D. 现有一含有 FeCl2和 FeCl3的混合样品,采用一定方法测得 n(Fe): n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为 10%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸的工业生产主要分为三步:第一步,矿石燃烧的设备叫_______,其中发生的主要反应式是_______;第二步制备三氧化硫的设备是_______,发生的主要化学反应方程式是:_______;第三步用_______而不用水吸收的主要原因是_______;最后的尾气中所含污染空气的主要有害物质是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一密闭容器中充入NO2在一定条件下进行反应 2NO2(g) ![]() 2NO(g)+O2(g),该反应达到平衡状态的标志是( )
2NO(g)+O2(g),该反应达到平衡状态的标志是( )
A. NO2的生成速率等于NO的消耗速率
B. NO2和O2的浓度之比等于2:1
C. 容器内压强不再随时间变化而变化
D. v(NO):V(O2)=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学小组同学在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | - | - |

请回答下列问题:
(1)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl制取无水FeCl2并测定FeCl3的转化率。按上图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯。打开K1、K2,关闭K3,通一段时间H2后关闭K2,控制三颈烧瓶内反应温度在128-139℃,反应一段时间。反应完成后打开K2再通氢气一段时间。
①仪器a的名称是______,装置B中盛装的试剂是______。
②反应后再通入H2的目的是______。
③冷却实验装置,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是______。
④反应后将锥形瓶中溶液配成250mL溶液,取25.00mL所配溶液,用0.4molL-1NaOH溶液滴定,消耗NaOH溶液23.60mL,则氯化铁的转化率为______。
(2)打开K1、K3,关闭K2,通氢气与氯化铁反应制取无水FeCl2。
①写出反应的化学方程式______。
②实验制得FeCl2后并防止氧化的操作是______。
③请指出该制备方法的缺点______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 因发生加成反应,苯可使溴水褪色
B. C5H10能使酸性KMnO4溶液褪色的同分异构体共有4种
C. ![]() 分子中最多有12个原子共平面
分子中最多有12个原子共平面
D. 将![]() 分子中的一个N原子换成C原子后,其分子式为C7H13N3
分子中的一个N原子换成C原子后,其分子式为C7H13N3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如图:

(1)粗盐中含CaCl2、MgCl2等杂质,写出精制过程中发生反应的化学方程式是__,__。
(2)如果粗盐中SO42-含量较高,必须添加钡式剂除去SO42-,该钡试剂可以是__。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(3)电解过程中所发生反应的化学方程式为___,与电源正极相连的电极附近产生的气体是__,检验该气体可使用___试纸,现象是试纸变为___色。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com