
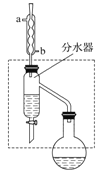
【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯(CH3COOCH2CH2CH2CH3)的反应装置示意图和有关信息如下:
乙酸 | 正丁醇 | 乙酸丁酯 | |
熔点/℃ | 16.6 | -89.5 | -73.5 |
沸点/℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。写出制备乙酸丁酯的化学方程式_________。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)口通入;通过分水器不断分离除去反应生成的水的目的是_____________。(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。①正确的操作步骤是________________(填标号)。
A.①②③④ B.③①④② C.④①③② D.③④①②
②在乙酸丁酯的精制中,用10%碳酸钠洗涤的主要目的是_________。
③在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸丁酯从分液漏斗的上口倒出
b.直接将乙酸丁酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸丁酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸丁酯从上口倒出
(3)计算产率
测量分水器内由乙酸与丁醇反应生成的水体积为1.8 mL,假设在制取乙酸丁酯过程中反应物和生成物没有损失,且忽略副反应,乙酸丁酯的产率为________。
【答案】CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O b 分离生成的水,使平衡正向移动,提高产品的产率 C 洗掉浓硫酸和过量的乙酸 d 77.1%
CH3COOCH2CH2CH2CH3+H2O b 分离生成的水,使平衡正向移动,提高产品的产率 C 洗掉浓硫酸和过量的乙酸 d 77.1%
【解析】
(1)根据冷水从下进上出冷却效果好判断进水口,正丁醇和冰醋酸反应生成乙酸丁酯和水,水的密度大,除掉生成物平衡右移;
(2)①根据各物质的溶解性及性质进行排序;
②饱和碳酸钠溶液能洗掉浓硫酸和过量的乙酸;
③乙酸丁酯的不溶于水,密度比水小,所以先从下口放出水溶液,再从上口倒出乙酸丁酯;
(3)先根据正丁醇的量计算理论上酯的量,再根据水的量计算实际上酯的量,实际上酯的量与理论值之比即为酯的产率。
(1)正丁醇和冰醋酸(过量)反应生成乙酸丁酯和水,反应的化学方程式为:CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O,冷凝管冷却时,采用逆流冷却的效果好,所以冷水从b进,生成乙酸丁酯的反应为可逆反应,生成物有水,分离生成的水,使平衡正向移动,提高产品的产率,所以要通过分水器不断分离除去反应生成的水,
CH3COOCH2CH2CH2CH3+H2O,冷凝管冷却时,采用逆流冷却的效果好,所以冷水从b进,生成乙酸丁酯的反应为可逆反应,生成物有水,分离生成的水,使平衡正向移动,提高产品的产率,所以要通过分水器不断分离除去反应生成的水,
故答案为:CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O ;b;分离生成的水,使平衡正向移动,提高反应产率。
CH3COOCH2CH2CH2CH3+H2O ;b;分离生成的水,使平衡正向移动,提高反应产率。
(2)①因为正丁醇和乙酸都具有挥发性,所以制取的酯中含有正丁醇和乙酸,第一步水洗除去酯中的正丁醇和乙酸;第二步用10%碳酸钠洗涤除去乙酸;第三步用水洗涤除去碳酸钠溶液;第四步用无水硫酸镁干燥除去水;第五步蒸馏,制得较纯净的酯。
故选C。
②制备乙酸丁酯时常用饱和碳酸钠溶液,目的是除去产品中含有的乙酸、硫酸等杂质降低乙酸丁酯在水中的溶解度,便于分层得到酯,
故答案为:除去产品中含有的乙酸、硫酸等杂质。
③由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸丁酯从上口放出,所以正确的为d,
故选d。
(3)12.0mL正丁醇的质量为12.0mL×0.8g/mL=9.6g,设12.0mL正丁醇理论上生成酯的质量为x,根据反应
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O 74g 116g 18g
CH3COOCH2CH2CH2CH3+H2O 74g 116g 18g
9.6g xg
74g/9.6g=116g/xg
解得x=15.05g,当反应生成的水体积为1.8mL即为1.8g时,实际产量为11.6g,所以产率=
11.6g÷15.05g×100%=77.1%,
故答案为:77.1%。


科目:高中化学 来源: 题型:
【题目】有机物A(C5H10O2)具有果香味,可用作食品加香剂,还可用作天然和合成树脂的溶剂。

已知:①B、E分子中没有支链;②D能与碳酸氢钠溶液反应放出二氧化碳;③D、E具有相同官能团;E的相对分子质量比D大14;④F可以使溴的四氯化碳溶液褪色。
(1).B的化学名称为__________。D分子中所含的官能团的名称是__________。
(2).B与E生成A的反应类型是__________。
(3).写出F使溴的四氯化碳溶液褪色的化学反应方程式:__________。
(4).A的结构简式为__________。
(5).写出B与Na反应的化学方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命法写出下列物质名称:
(1) _______________;
_______________;
(2)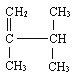 _______________;
_______________;
(3) 的系统名称为_______________;
的系统名称为_______________;
(4)键线式![]() 表示的分子式_______________;名称是_______________。
表示的分子式_______________;名称是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉是由氯气通入石灰乳制得,漂白粉的成分是CaCl2、Ca(ClO)2及少量Ca(OH)2,其中有效成分中氯元素的化合价是( )
A.-2价B.-1价C.+1价D.+3价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确是
A.溴元素被称为“海洋元素”
B.I、Mg、Br、U元素属于海水中的微量元素
C.碘是人体必须微量元素,所以要多吃富含高碘酸的食物
D.Li、Cl、Na、K元素属于海水中的常量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是 ( )
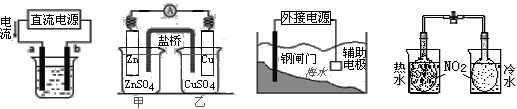
① ② ③ ④
A. 用装置①精炼铜,a极为粗铜,电解质溶液为CuSO4溶液
B. 装置②盐桥中KCl的Cl-移向乙烧杯
C. 装置③中钢闸门应与外接电源的负极相连获得保护
D. 装置④可以验证温度对化学平衡的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】共价键、离子键和分子间作用力是微粒之间的不同作用力,下列物质中含有上述两种作用力的是
①NaOH ②SiO2 ③NH4Cl ④金刚石 ⑤NaCl ⑥干冰.
A. ①③⑥ B. ①②④ C. ②④⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是

A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复到原浓度
D. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有由等质量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的物质的量之比为__________________;
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸中HCl的物质的量为_____________mol;
(3)如果盐酸过量,生成CO2的体积为______________L;
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道_______________;
(5)若NaHCO3和KHCO3不是以等质量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com