
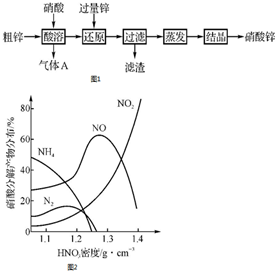
 硝酸锌常用于工业电镀、媒染剂等,用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如图1.活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同.如图2是Fe与不同浓度HNO3溶液反应时的主要还原产物.
硝酸锌常用于工业电镀、媒染剂等,用粗锌[含少量Zn2(OH)2CO3、Fe和Cu]和硝酸为原料制备硝酸锌的实验流程如图1.活泼金属(如Zn、Fe、Mg等)与不同浓度HNO3溶液反应时主要还原产物不同.如图2是Fe与不同浓度HNO3溶液反应时的主要还原产物.分析 粗锌[含少量Zn2(OH)2CO3、Fe和Cu]加入硝酸溶解,根据硝酸的强氧化性则所得溶液中含有三价铁、二价锌、二价铜离子,再加入过量的锌,置换出溶液中的铁和铜,过滤得滤渣为Fe、Cu和过量的Zn,滤液为硝酸锌溶液,经过蒸发浓缩、降温结晶可得硝酸锌晶体,据此答题.
解答 解:粗锌[含少量Zn2(OH)2CO3、Fe和Cu]加入硝酸溶解,根据硝酸的强氧化性则所得溶液中含有三价铁、二价锌、二价铜离子,再加入过量的锌,置换出溶液中的铁和铜,过滤得滤渣为Fe、Cu和过量的Zn,滤液为硝酸锌溶液,经过蒸发浓缩、降温结晶可得硝酸锌晶体,
(1)根据上面的分析可知,滤渣的成分是Fe、Cu、Zn,
故答案为:Fe、Cu、Zn;
(2)Zn2(OH)2CO3与硝酸反应生成硝酸锌、二氧化碳和水,反应的离子方程式为Zn2(OH)2CO3+4H+=2Zn2++CO2↑+3H2O,
故答案为:Zn2(OH)2CO3+4H+=2Zn2++CO2↑+3H2O;
(3)根据电子得失守恒和元素守恒可知,锌与硝酸反应生成NH4+的同时还有硝酸锌和水生成,反应的离子方程式为4Zn+10H++NO3-=4Zn2++NH4++3H2O,
故答案为:4Zn+10H++NO3-=4Zn2++NH4++3H2O.
点评 本题考查较为综合,涉及氧化还原反应、离子方程式书写、工业流程分析等,侧重于学生的分析能力和实验能力的考查,为高频考点和常见题型,题目难度中等,注意把握基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氮原子的氮气的体积约为11.2L | |
| B. | 标准状况下,11.2L H2O含有的分子数为0.5NA | |
| C. | 常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| D. | 常温常压下,64g SO2中含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18.0g NH4+中所含的质子数为10NA | |
| B. | 室温下,8g甲烷含有共价键数为2NA | |
| C. | 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA | |
| D. | 111g CaCl2晶体中所含共用电子对的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 用托盘天平准确地称取6.82g食盐 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度可以比水大也可以比水小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现象相同,生成Al(OH)3的量相同 | B. | 现象不同,生成Al(OH)3的量相同 | ||
| C. | 现象相同,生成Al(OH)3的量不同 | D. | 现象不同,生成Al(OH)3的量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量是98克 | |
| B. | 阿伏加德常数个微粒的物质的量是1mol | |
| C. | 1mol 12C原子的质量为12g | |
| D. | 6.02×1023mol-1是阿伏加德罗常数的近似值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com