
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼酸(H3BO3)在水中电离出阴离子B(OH)4-,请试着写出硼酸的电离方程式___________。
(2)已知:H3BO3的电离常数Ka=5.8×1010,H2S的电离常数掏Ka1=5.7×108、Ka2=1.2×1015,向饱和硼酸溶液中滴加0.1 mol·L1 Na2S溶液,写出发生反应的离子方程式_________。
(3)BCl3主要用作半导体硅的掺杂源,遇水强烈水解,0.01mol BCl3溶于300mL蒸馏水中(溶液体积变化忽略不计),则所得溶液的pH值约为___________。
【答案】H3BO3+H2O![]() H++ B(OH)4- S2-+H3BO3= HS-+H2BO3-或S2-+H3BO3=HS-+BO2-+H2O 1
H++ B(OH)4- S2-+H3BO3= HS-+H2BO3-或S2-+H3BO3=HS-+BO2-+H2O 1
【解析】
(1)根据电离方程式的书写规则及电荷守恒、原子守恒分析解答;(2)根据电离平衡常数与酸性强弱的关系分析解答;(3)根据水解方程式及pH表达式进行相关计算。
(1)硼酸(H3BO3)在水中电离出阴离子B(OH)4-,则根据原子守恒及电荷守恒分析知,硼酸的电离方程式为H3BO3+H2O![]() H+ + B(OH)4-,故答案为:H3BO3+H2O
H+ + B(OH)4-,故答案为:H3BO3+H2O![]() H+ + B(OH)4-。
H+ + B(OH)4-。
(2)根据平衡常数的大小分析知酸性强弱顺序为:H2S>H3BO3>NaHS,则根据强酸制弱酸原理,向饱和硼酸溶液中滴加0.1 mol·L1 Na2S溶液,反应生成NaHS、NaH2BO3,离子方程式为S2-+H3BO3= HS-+H2BO3-,故答案为:S2-+H3BO3= HS-+H2BO3-或S2-+H3BO3=HS-+BO2-+H2O;
(3)根据BCl3水解方程式计算得:BCl3+3H2O=H3BO3+3HCl,c(H+)=![]() ,所以Ph=-lg c(H+)=1,故答案为:1。
,所以Ph=-lg c(H+)=1,故答案为:1。


科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。
方案一:按下图装置进行实验。并回答以下问题。
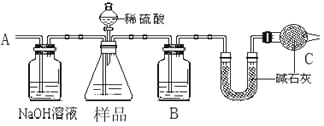
①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为______,C装置的作用是__________________________。
(2)从导管A处缓缓鼓入一定量的空气的目的是_______________。
(3)该样品中NaHCO3的质量分数为_____________。
方案二:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量Ba(OH)2溶液。过滤洗涤,干燥沉淀,称量固体质量,进行有关计算。
请回答:实验中判断沉淀是否完全的方法是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于金属腐蚀的叙述中,正确的是( )
A.金属被腐蚀的本质是M+nH2O=M(OH)n+![]() H2↑
H2↑
B.马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C.金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D.常温下,置于空气中的金属主要发生化学腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成:

下列说法正确的是( )
A.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有4种
B.邻羟基苯甲醛分子中所有的原子不可能在同一平面
C.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应①
D.反应②中加入适量的NaHCO3可提高阿司匹林的产率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①CO燃烧热为283.0kJ·mol-l,②N2(g)+O2(g) =2NO(g) △H=+180.5kJ·mol-1,汽车尾气中的NO(g)和CO(g)在一定温度和催化剂条件下可发生反应,能消除污染,写出该反应的热化学方程式______________。
(2)某温度下,等物质的量的碘和环戊烯(![]() )在刚性容器内发生反应:
)在刚性容器内发生反应:![]() (g)+ I2(g)
(g)+ I2(g)![]()
![]() (g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
(g)+2HI(g) ΔH=+89.3 kJ·mol 1,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为____,该反应的平衡常数Kp=____Pa(用平衡分压代替平衡浓度,分压=总压×物质的量分数)。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有____(填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度由小到大的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示。下列有关叙述正确的是
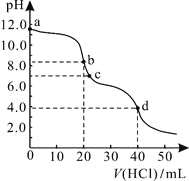
A. a点溶液呈碱性的原因用离子方程式表示为:CO![]() +2H2O
+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. c点处的溶液中c(Na+)-c(Cl-)=c(HCO![]() )+2c(CO
)+2c(CO![]() )
)
C. 滴定过程中使用甲基橙作为指示剂比酚酞更准确
D. d点处溶液中水电离出的c(H+)大于b点处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究固体甲(含两种元素)和固体乙(无机矿物盐,含五种元素)的组成和性质,设计并完成了如下实验:

已知:向溶液1中连续滴加盐酸,先产生白色沉淀,后沉淀溶解;向溶液2中连续通入气体2,也是先产生白色沉淀,后沉淀溶解。请回答下列问题:
(1)甲的化学式____________,乙的化学式______________。
(2)加热条件下,气体1与固体2反应,产物中有一种气体和一种固体,该反应的化学方程式为__________________。
(3)气体2与足量溶液1反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一氧化碳变换反应CO + H2O![]() CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
CO2 + H2中,有关反应条件改变使反应速率增大的原因分析不正确的是
A.使用催化剂,活化分子百分数增大,有效碰撞几率增加
B.升高温度,活化分子百分数增大,有效碰撞几率增加
C.增大压强,单位体积内活化分子数增多,有效碰撞几率增加
D.增大c(CO),活化分子百分数增大,有效碰撞几率增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A.v(NH3)=0.05 mol/(Lmin)B.v(NH3)=0.2 mol/(Lmin)
C.v(H2)=0.3 mol/(Lmin)D.v(H2)=0.4 mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com