
| A.CuFeS2中硫的化合价为-1 |
| B.CuFeS2发生还原反应 |
| C.1 mol CuFeS2完全反应转移13 mol电子 |
| D.CuSO4和SO2既是氧化产物,又是还原产物 |
科目:高中化学 来源:不详 题型:单选题
| A.H2S+2HNO3═S↓+2NO2↑+2H2O | ||||
| B.CuO+2HNO3═Cu(NO3)2+H2O | ||||
| C.3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O | ||||
D.4HNO3
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.M | B.M2+ | C.M3+ | D.MO2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


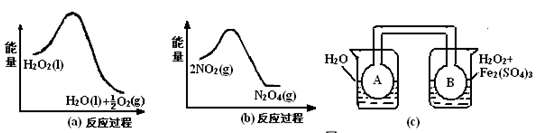
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
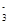 与R-可发生反应:RO
与R-可发生反应:RO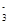 +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )| A.元素R位于周期表中第ⅤA族 |
B.RO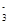 中的R只能被还原 中的R只能被还原 |
C.若1mol RO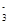 参与该反应,则转移的电子的物质的量为5mol 参与该反应,则转移的电子的物质的量为5mol |
| D.R2在常温常压下一定是气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.9.0L | B.13.5L | C.15.7L | D.16.8L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D.若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
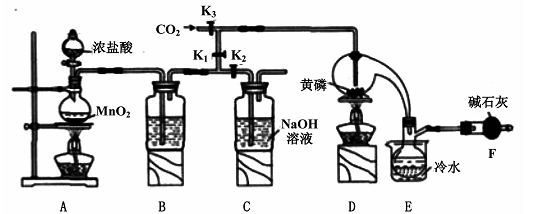
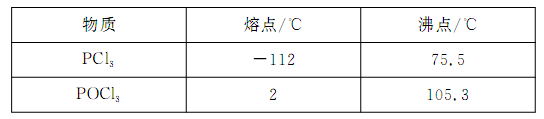
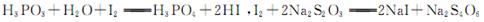 已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com