
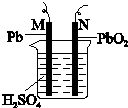
 已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )
已知铅蓄电池的反应原理是:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)△H<0图为铅蓄电池的示意图.下列说法正确的是( )| A. | 充电时,阳极的电极反应式为:PbSO4+2e-═Pb+SO42- | |
| B. | 充电时,若N连接电源正极,则该极生成PbO2 | |
| C. | 放电时,c(H2SO4)不变,两极的质量增加 | |
| D. | 放电时,N为负极,其电极反应式为:PbO2+SO42-+4H++2e-═PbSO4+2H2O |
分析 由总方程式可知,为原电池时,Pb为负极,发生氧化反应,电极方程式为Pb+SO42--2e-=PbSO4,PbO2为正极,发生还原反应,电极方程式为PbO2+4H++SO42--2e-=2H2O+PbSO4,在充电时,阴极发生的反应是PbSO4+2e-=Pb+SO42-,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,结合电极方程式解答该题.
解答 解:A.充电时,阳极发生氧化反应,阳极反应为PbSO4-2e-+2H2O=PbO2+SO42-+4H+,故A错误;
B.充电时,若N连接电源正极,则N极是阳极,该电极上是硫酸铅失电子发生氧化反应,生成PbO2,故B正确;
C.由方程式Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O(l)可知,放电时,c(H2SO4)减小,两极都产生硫酸铅,电极的质量增加,故C错误;
D.电池放电时,正极发生还原反应,反应方程式为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,N为正极,故D错误;
故选B.
点评 本题考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合考查,为高考常见题型和高频考点,注意把握电解方程式的书写,难度不大.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | 碘水,变蓝色;浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀 | |
| B. | 浓硝酸,变黄色;新制Cu(OH)2,砖红色沉淀;碘水,变蓝色 | |
| C. | 新制Cu(OH)2,砖红色沉淀;碘水,变蓝色;浓硝酸,变黄色 | |
| D. | 碘水,变蓝色;新制Cu(OH)2,砖红色沉淀;浓硝酸,变黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的体积分数不再发生改变 | |
| B. | A、B、C的物质的量浓度相等 | |
| C. | A、B、C的物质的量之比为1:3:2 | |
| D. | 单位时间生成n mol A,同时生成3n mol B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,2.24LHF中所含电子数为0.1NA | |
| B. | 常温常压下,4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 | |
| D. | 1 mol Na2O2固体中含离子总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag | |
| B. | Ba(OH)2与稀H2SO4反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | 向澄清石灰水中通入足量二氧化碳:OH-+CO2═HCO3- | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++2H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有较高能量的分子是活化分子 | |
| B. | 活化分子间的碰撞一定是有效碰撞 | |
| C. | 不同化学反应需要的活化能有可能差别很大 | |
| D. | 反应的活化能大小不会影响化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com