
分析 Ⅰ、常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液,溶液中存在电荷守恒,根据电荷守恒得n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-);
Ⅱ、(1)弱电解质的水溶液中,弱电解质在溶液中只有部分电离,反应速率与氢离子浓度成正比;
(2)只有改变条件时,才能证明改变条件弱电解质平衡发生移动;
(3)使HA的电离程度和c(H+)都减小,c(A-)增大,则应该加入含有A-的物质;
(4)稀释相同的倍数,A的变化大,则A的酸性比B的酸性强,溶液中氢离子浓度越大,酸性越强,对于一元强酸来说c(酸)=c(H+),但对于一元弱酸,c(酸)>c(H+).
解答 解:Ⅰ、常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液,溶液中存在电荷守恒,根据电荷守恒得n(CH3COO-)+n(OH-)-n(H+)=n(Na+)-n(Cl-)=0.010mol-0.004mol=0.006mol,
故答案为:0.006mol;
Ⅱ、(1)弱电解质的水溶液中,弱电解质只有部分电离,则0.1mol•L-1的HA溶液中氢离子浓度小于0.1mol/L,所以溶液的pH>1;
反应速率与氢离子浓度成正比,等浓度的HA和盐酸溶液中,HA中氢离子浓度小,所以开始时产生氢气的速率小,盐酸中氢离子浓度大,则产生氢气的速率大,所以A正确,BC错误,
故答案为:>,A;
(2)浓度越小,弱电解质的电离程度越大,所以加水稀释,弱酸HA的电离程度会增大,
故答案为:增大;
(3)使HA的电离程度和c(H+)都减小,c(A-)增大,则应该加入含有A-的物质,所以A中加入NaA固体(可完全溶于水)正确,
故答案为:A;
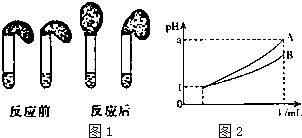
(4)A.若a=4,A完全电离,则A是强酸,B的pH变化小,则B为弱酸,故A正确;
B.pH=1的酸,加水稀释到1000倍,若pH=4,为强酸,若a<4,则A、B 都是弱酸,故B正确;
C.根据图2可知,稀释1000倍后A的pH值变化大于B,说明A的酸性大于B,当pH相同时,A的浓度一定小于B,故C错误;
D.溶液的PH越大,氢离子浓度越小,其酸性越弱,由图2可知,A的pH大于B,则稀释后,A溶液的酸性比B溶液弱,故D正确;
故答案为:C.
点评 本题考查离子浓度大小比较、弱电解质电离等知识点,明确强酸与弱酸在稀释时pH变化程度大、酸的浓度和氢离子的浓度的关系是解答本题的关键,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| B. | 往CuCl2溶液中加入钠 2Na+Cu2+═2Na++Cu | |
| C. | 铁与稀硫酸反应 Fe+2H+═Fe2++H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液反应 H++SO42-+Ba2++OH-═H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成纤维、光导纤维都属于有机高分子材料 | |
| B. | 道尔顿、阿伏伽德罗、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识 | |
| C. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| D. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,新修订的《环境空气质量标准》增设了PM2.5平均浓度限值,是因为PM2.5在空气中形成了分散系一定是气溶胶,且富含有害物质,对空气质量影响较大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤ | B. | ①③⑤ | C. | ③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中NO2-被还原 | |
| B. | 生成1mol NaNO3需消耗0.4mol KMnO4 | |
| C. | 反应过程中溶液的pH减小 | |
| D. | □中的粒子是OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内只含有18O2、SO2、SO3三种分子 | |
| B. | 18O只存在18O2分子中 | |
| C. | 容器内含有18O2、S18O2、S18O3等分子 | |
| D. | 反应达到限度时,容器内只含有18O2、S18O2、S18O3分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
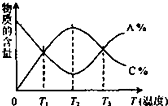 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 升高温度,平衡会向正反应方向移动 | |
| C. | 该反应的逆反应是放热反应 | |
| D. | 该反应在T2温度时达到化学平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com