
| A、玻璃 | B、水晶 | C、水泥 | D、橡胶 |
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验结论 |
| A. | 向某有机物中加入少量溴水,充分振荡后观察到溴水褪色 | 该有机物中一定有碳碳双键存在 |
| B. | 向淀粉水解液中加入氢氧化钠溶液至碱性,再加入新制氢氧化铜,加热,有砖红色沉淀生成 | 水解产物中含有醛基 |
| C. | 向无水乙醇中加入浓硫酸,加热,将产生的气体通入酸性高锰酸钾溶液,高锰酸钾溶液褪色 | 产生的气体一定是乙烯 |
| D. | 将二氧化碳通入苯酚钠溶液中,溶液出现浑浊 | 苯酚酸性比碳酸酸性强 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下pH相同的下列溶液:①NaHCO3 ②Na2CO3 ③CH3COONa,其溶液的浓度由大到小的顺序是:③>①>② |
| B、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)═c(OH-)+c(HA-)+c(A2-) |
| C、pH=10的NaOH溶液与pH=4的CH3COOH溶液等体积混合:C(Na+)>C(CH3COO-)>C(OH-)>C(H+) |
| D、0.1mol/L的氨水溶液与0.05mol/LH2SO4溶液等体积混合后所得溶液中:C(NH4+)+C(NH3?H2O)+C(NH3)═C(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定有Al3+离子 |
| B、可能有HCO3-离子 |
| C、不能确定SO32-离子是否存在 |
| D、不存在Fe2+离子,可能存在Ba2+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
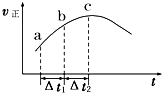 向绝热恒容密闭容器中通入SO2和NO2,一定条件下使可逆反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出正确的结论是( )
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使可逆反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示.由图可得出正确的结论是( )| A、反应在 c 点达到平衡状态 |
| B、反应物浓度:a 点小于 b 点 |
| C、反应物的总能量低于生成物的总能量 |
| D、△t1=△t2 时,SO2 的转化率:a~b 段小于 b~c 段 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2a+3(b+d-e)+c kJ/mol |
| B、a+3(2b+d-e)-c kJ/mol |
| C、3(d+e-b)+c-2a kJ/mol |
| D、2a+3(b-d-e)-c kJ/mol |
| E、2a+3(b-d-e)-c kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com