
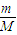 可知质量都为3g的镁和铝的物质的量,进而计算二者物质的量之比;
可知质量都为3g的镁和铝的物质的量,进而计算二者物质的量之比;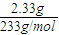 =0.01mol,根据硫酸根守恒,计算原溶液中c(SO42-),进而计算c (NO3-).
=0.01mol,根据硫酸根守恒,计算原溶液中c(SO42-),进而计算c (NO3-).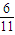 ,据此计算.
,据此计算.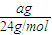 =
=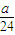 mol,n(Al)=
mol,n(Al)=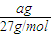 =
=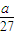 mol,所以n(Mg):n(Al)=
mol,所以n(Mg):n(Al)=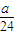 mol:
mol: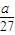 mol=9:8;
mol=9:8;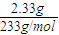 =0.01mol,根据硫酸根守恒原溶液中c(SO42-)=
=0.01mol,根据硫酸根守恒原溶液中c(SO42-)=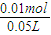 =0.2mol/L,所以原溶液中计算c(NO3-)=1mol/L-2×0.2mol/L=0.6mol/L.
=0.2mol/L,所以原溶液中计算c(NO3-)=1mol/L-2×0.2mol/L=0.6mol/L.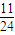 =
=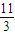 mol,反应中只有P元素的化合价升高,由0价升高为+5价,起还原剂作用的P占参加反应的P的
mol,反应中只有P元素的化合价升高,由0价升高为+5价,起还原剂作用的P占参加反应的P的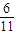 ,转移电子数为
,转移电子数为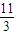 mol×
mol×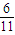 ×5×6.02×1023 mol-1=6.02×1024.
×5×6.02×1023 mol-1=6.02×1024.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:


| 元素 | M | F | |
| 电离能(kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 112 | ||||
6.02×1023×(
|
| 112 | ||||
6.02×1023×(
|
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 比任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com