
【题目】某化学兴趣小组为合成1-丁醇,查阅资料得知如下合成路线CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:CO 的制备原理:HCOOH ![]() CO↑+H2O。
CO↑+H2O。
(1)正丁醛经催化加氢得到含少量正丁醛的 1-丁醇粗品。为纯化 1-丁醇,该小组查阅文献得知:
①R—CHO+NaHSO3(饱和) →RCH(OH)SO3Na↓;
②沸点:乙醚 34℃,1-丁醇 118℃,并设计出如下提纯路线:
![]()
试剂1为 ,操作3为 。
(2)原料气CH3CH=CH2、CO和H2的制备装置图设计如下:
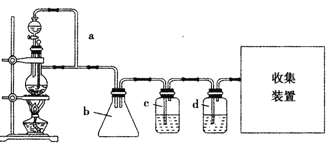
填写下列空白:
①若用上述装置制备干燥纯净的CO气体,装置b的作用是 ;c中盛装的试剂是 。
②若用上述装置制备氢气,收集装置可选用下列装置
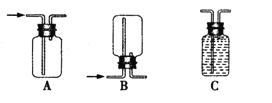
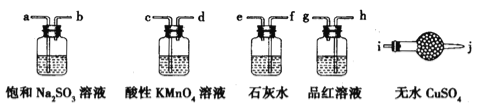
③实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备丙烯,写出反应的化学方程式: 。 制丙烯时,产生的气体除了丙烯及水蒸气外,还存在CO2、SO2;为检验这四种气体,下列装置按气流方向的连接顺序为 。
【答案】
(1)饱和NaHSO3溶液;蒸馏;
(2)①防倒吸;NaOH溶液; ②BC;
③CH3CHOHCH3![]() CH2=CHCH3↑+H2O;i、j、h、g、a、b、f、e、c、d;
CH2=CHCH3↑+H2O;i、j、h、g、a、b、f、e、c、d;
【解析】
试题分析:(1)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开,故答案为:饱和NaHSO3溶液;蒸馏;
(2)①甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.又因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO,故答案为:防倒吸; NaOH溶液;
②氢气密度小于空气的,因此要收集氢气,可以用向下排空气法,也可以用排水法收集,故选BC;
③2-丙醇在浓硫酸存在条件下加热,发生分子内的脱水反应生成丙烯,反应的化学方程式为CH3CHOHCH3![]() CH2=CHCH3↑+H2O,检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必需考虑试剂的选择和顺序.只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,装置间的连接顺序为i、j、h、g、a、b、f、e、c、d,故答案为:CH3CHOHCH3
CH2=CHCH3↑+H2O,检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必需考虑试剂的选择和顺序.只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,装置间的连接顺序为i、j、h、g、a、b、f、e、c、d,故答案为:CH3CHOHCH3![]() CH2=CHCH3↑+H2O;i、j、h、g、a、b、f、e、c、d;
CH2=CHCH3↑+H2O;i、j、h、g、a、b、f、e、c、d;


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料,可由乙烷为原料制取,回答下列问题。
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
①C2H6(g)=C2H4(g) +H2(g) ΔH1=+136 kJ/mol
②C2H6(g)+ ![]() O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol
O2(g)= C2H4(g)+H2O(g) ΔH2=-110 kJ/mol
已知反应相关的部分化学键键能数据如下:
化学键 | H-H(g) | H-O(g) | O=O(g) |
键能( kJ/mol) | 436 | X | 496 |
由此计算x=_________,通过比较△H1和△H2,说明和热裂解法相比,氧化裂解法的优点是_______________________________(任写一点)。
(2)乙烷的氧化裂解反应产物中除了C2H4外,还存在CH4、CO、CO2等副产物(副反应均为放热反应),图1为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温度的升高而升高的原因是______,反应的最佳温度为____________(填选项序号)。
A.700℃ B.750℃ C.850℃ D.900℃
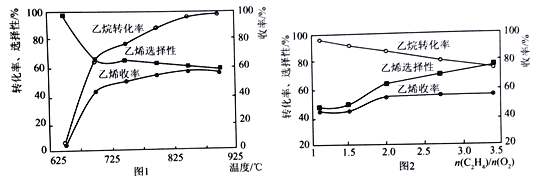
[乙烯选择性=![]() ;乙烯收率=乙烷转化率×乙烯选择性]
;乙烯收率=乙烷转化率×乙烯选择性]
(3)烃类氧化反应中,氧气含量低会导致反应产生积炭,堵塞反应管。图2为n(C2H6)/n(O2)的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中n(C2H6)/n(O2)的最佳值是_______________,判断的理由是__________________________________。
(4)工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是___________________________。
反应达平衡时,各组分的体积分数如下表:
C2H6 | O2 | C2H4 | H2O | 其他物质 |
2.4% | 1.0% | 12% | 15% | 69.6% |
计算该温度下的平衡常数Kp=_________(用平衡分压代替平衡浓度,平衡分压=总压×体积分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】咖啡中的咖啡酸具有抗氧化、抗炎、抗粥样硬化等多种有益作用。其球棍模型如图所示,关于咖啡酸的下列说法正确的是
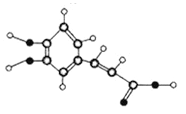
A. 分子式为C9H10O4
B. 分子中至少有9个碳原子共平面
C. 1 mol咖啡酸与足量NaHCO3反应生1 mol CO2
D. 1 mol咖啡酸最多能够与5 mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾 (K2Cr2O7),其工艺流程及相关物质溶解度曲线如下图所示。
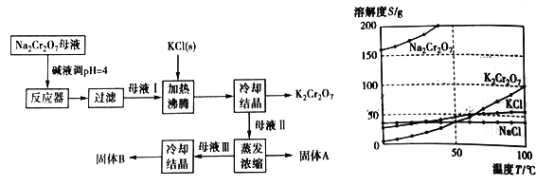
(1)向Na2Cr2O7母液中加碱液调pH的目的是_____________________。
(2)通过冷却结晶析出大量K2Cr2O7的原因是________________________________。
(3)固体A的主要成分为__________(填化学式),用热水洗涤固体A,回收的洗涤液转移到母液___________(填“I”“Ⅱ”或“Ⅲ”)中,既能提高产率又可使能耗降低。固体B的主要成分为___________________(填化学式)。
(4)测定产品中K2Cr2O7含量的方法如下:称取产品试样2.500 g 配成250 mL溶液,用移液管取出25.00 mL于碘量瓶中,加入10 mL 2 mol·L-l H2SO4溶液和足量KI溶液(铬的还原产物为Cr3+),放置于暗处5 min,然后加入100 mL蒸馏水、3 mL 淀粉指示剂,用0.1200 mol·L-l Na2S2O3标准溶液滴定(已知I2+ 2S2O32-=2I-+S4O62-)。
①酸性溶液中KI 与K2Cr2O7反应的离子方程式为_____________________________。
②若实验中共用去Na2S2O3标准溶液40.00 mL,则所得产品中重铬酸钾的纯度为__________%( 保留2 位小数,设整个过程中其他杂质不参与反应)。进一步提纯产品的方法是___________________。
(5)+6价Cr的毒性很高,工业上用电解法来处理含Cr2O72-的废水。下图为电解装置示意图,电极材料分别为铁和石墨。通电后,Cr2O72-在b极附近转变为Cr3+,一段时间后Cr3+最终可在a 极附近变成Cr(OH)3沉淀而被除去。
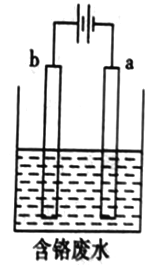
①在以上处理过程中,Cr2O72-转化为毒性较低的Cr3+的离子方程式为________________________。
②a电极的电极反应式是是____________________;电解一段时间后在阴极区有Fe(OH)3和Gr(OH)3沉淀生成,若电解后的溶液中c(Cr3+)为3×10-5mol·L-1,则溶液中c(Fe3+)为____________ mol·L-1。已知:Ksp=[Fe(OH)3]=4.0×10-38,K[Cr(OH)3]=6.0×10-31。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: ![]()
![]()
![]() ,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径:
,为合成某种液晶材料的中间体M,有人提出如下不同的合成途径: 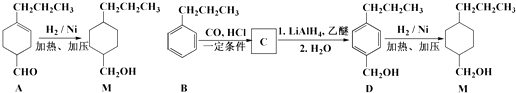
(1)常温下,下列物质能与A发生反应的有(填序号). a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)由A催化加氢生成M的过程中,可能有中间生成物 ![]() 和(写结构简式)生成.
和(写结构简式)生成.
(3)检验D中是否含有C可选用的试剂是(任写一种名称).
(4)物质D也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为 .
(5)C的一种同分异构体E具有如下特点: a.分子中含﹣OCH2CH3 b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃/101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量,下列表示该反应的热化学方程式正确的是( )
A.CH4O(l)+ ![]() O2(g)=CO2(g)+2H2O(g)△H=﹣725.8kJmol﹣1
O2(g)=CO2(g)+2H2O(g)△H=﹣725.8kJmol﹣1
B.2CH4O(l)+3O2(g)=2CO2(g)+2H2O(l)△H=+1451.6kJmol﹣1
C.2CH4O(l)+3O2(g)=2CO2(g)+4H2O(l)△H=﹣22.68kJmol﹣1
D.CH4O(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣725.8kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣725.8kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是 ( )
A. pH=7的溶液
B. c(H+)=c(OH-)的溶液
C. 由强酸、强碱等物质的量反应得到的溶液
D. 非电解质溶于水得到的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾与水反应的实验如下图所示:

(1)钠、钾与水反应两个实验现象的相同点:
①金属________水面上;
②金属________成闪亮的小球;
③小球四处游动;
④产生嘶嘶的声音;
⑤反应后的溶液使酚酞________。
(2)_______与水反应有轻微的爆鸣声,并很快燃烧起来。
(3)实验结论:________更易与水反应,且反应更_____________________________________。
(4)钾与水反应的化学方程式是___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C2H6O的化合物A具有如下性质:
A+Na→慢慢产生气泡
A+CH3COOH![]() 有香味的产物
有香味的产物
(1)根据上述信息,对该化合物可作出的判断是 ______ .
A.一定含有-OH B.一定含有-COOH C.A为乙醇 D.A为乙醛
(2)含A的体积分数为75%的水溶液可以用作 ______ .
(3)A与钠反应的化学方程式: ________________________________________ .
(4)化合物A与CH3COOH反应生成的有香味的产物的结构简式为:________________ .
(5)写出A分子在催化剂存在条件下加热和氧气反应的化学方程式:___________________.
(6)如图是B分子的球棍模型和A分子的比例模型,若A和B的关系是同系物,则B的结构简式 ______ .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com