
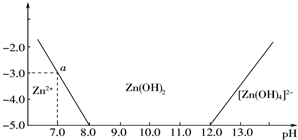
分析 (1)由图象可知溶液的碱性较强时,锌的存在形式为[Zn(OH)4]2-,结合元素守恒书写方程;
(2)根据图中数据,利用Ksp=c(Zn2+)•c2(OH-)计算.
解答 解:(1)由图象可知溶液的碱性较强时,锌的存在形式为[Zn(OH)4]2-,所以该反应的离子方程式为:Zn2++4OH-═[Zn(OH)4]2-,
故答案为:Zn2++4OH-═[Zn(OH)4]2-;
(2)当溶液的pH=7.0时,c(Zn2+)=10-3mol•L-1,Ksp=c(Zn2+)•c2(OH-)=10-3×(10-7)2=10-17,
故答案为:10-17.
点评 本题考查了难溶电解质的溶解平衡及其计算,题目难度中等,正确分析图象中数据为解答关键,注意熟练掌握溶度积的概念及计算方法,试题培养了学生灵活应用基础知识的能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 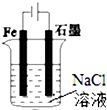 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红 | |
| B. | 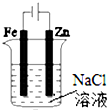 图②装置可以验证牺牲阳极的阴极保护法 | |
| C. |  图③可以模拟钢铁的吸氧腐蚀,铁棒一极的电极反应式:Fe=Fe 2++2e- | |
| D. | 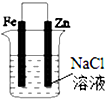 分别给上述4个装置的铁电极附近滴加少量K3[Fe(CN)6]溶液,②④出现蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有2对 | |
| B. | 某元素能形成+7价的含氧酸及其盐,则该元素一定为主族元素 | |
| C. | L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等 | |
| D. | 同主族两种短周期元素原子序数之差不可能是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
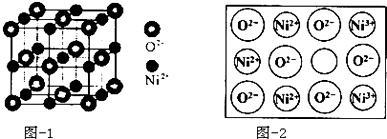
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
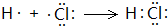 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
乙醇分子中不同的化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )| A. | 与金属钠作用时,键①断 | |
| B. | 浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和乙酸、浓硫酸共热时,键②断裂 | |
| D. | 在银催化下和氧气反应时,键①和④断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
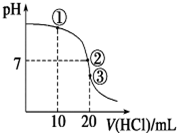 常温下,在20.00mL 0.100 0mol•L-1 NH3•H2O溶液中逐滴滴加0.1000mol•L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示.下列说法正确的是( )
常温下,在20.00mL 0.100 0mol•L-1 NH3•H2O溶液中逐滴滴加0.1000mol•L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如右图所示.下列说法正确的是( )| A. | ①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| C. | ①、②、③三点所示的溶液中水的电离程度②>③>① | |
| D. | 滴定过程中不可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com