
| A. | 0.64g | B. | 1.28g | C. | 2.56g | D. | 5.12g |
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水,浓硫酸 | B. | 酸性高锰酸钾溶液,浓硫酸 | ||
| C. | 溴水,烧碱溶液,浓硫酸 | D. | 浓硫酸,酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的结构简式:N-N | B. | 中子数为20的氯原子:${\;}_{17}^{20}$Cl | ||
| C. | CCl4的电子式: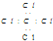 | D. | F原子的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Na+) | B. | c(Na+)=c(CH3COO-)+c(CH3COOH) | ||
| C. | c(CH3COOH)<c(CH3COO-) | D. | c(CH3COOH)+c(CH3COO-)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阳极发生氧化反应,其电极反应式主要是:Ni-2e-=Ni2+ | |
| B. | 电解过程中,阳极质量的减少与阴极质量的增加不相等 | |
| C. | 电解后,溶液中存在的金属阳离子只有Fe2+、Ni2+和Zn2+ | |
| D. | 电解后,电解槽底部的阳极泥中只有Pt |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冰→水若自发进行,△H<T△S | B. | 水→冰若自发进行,△H<0 | ||
| C. | 冰?水的平衡状态△H=T△S | D. | 水?冰的平衡状态,△H=0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
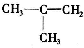 、CH3CH=CHCH3和CH3CH2CH=CH2.
、CH3CH=CHCH3和CH3CH2CH=CH2. ,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.
,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{电解}{→}$Mg | |
| B. | 海水$\stackrel{HCl}{→}$MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg | |
| C. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 海水$\stackrel{石灰乳}{→}$ Mg(OH)2$\stackrel{BCl}{→}$ MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com