
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验用品:电极( 、 )、稀硫酸、 (填写所缺的实验用品)、耳机(或者电流计)
(3)实验装置 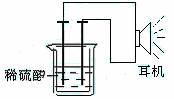
(4)原电池设计及注意的问题
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓…………”声音。其原因是:在原电池中,由化学能转化为 ,在耳机中又由 转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的 极,电极反应是: ,发生了 反应;铜钉应该接电流计的 极,电极反应是: ,发生了 反应。
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:高一化学 第2章 化学键 化学反应与能量 2.3.2化学反应为人类提供能量(鲁科版必修2) 题型:058
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池.请填写下列空白:
(1)实验原理:Fe+2H+![]() Fe2++H2↑.
Fe2++H2↑.
(2)实验用品:电极(________、________)、稀硫酸、________(填写所缺的实验用品)、耳机(或者电流计).
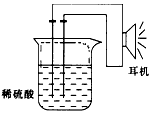
(3)实验装置
(4)原电池设计及注意的问题
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓”声音.其原因是:在原电池中,由化学能转化为________.

②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是:________;另一极应该接电流计的________极,电极发生了________反应.
查看答案和解析>>
科目:高中化学 来源:北京市朝阳区2010年高三一模(理科综合)化学部分 题型:填空题
(14分)铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=====FeSO4+Cu-
上述两种方法中,铜元素均被 (填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:

①证明步骤I所加FeCl3溶液过量的方法是 。
②步骤2中所加的氧化剂最适宜的是 。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是 。(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是 (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)=====CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O(l)====2H2O(l)+O2(g) △H2=-196kJ/mol
H2(g)+ O2(g)====H2O(l)
△H3=-286kJ/mol
O2(g)====H2O(l)
△H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)====CuSO4(aq)+H2(g)的△H= 。
(3)欲实现反应Cu+H2SO2====CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)

查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com