
 如图是中学化学常见的装置,可用该装置验证元素非金属性的强弱.
如图是中学化学常见的装置,可用该装置验证元素非金属性的强弱. 分析 (1)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,据此判断非金属性强弱;
(2)硝酸具有挥发性,也能和硅酸钠反应生成白色沉淀,影响碳酸和硅酸钠的反应;
(3)向亚硫酸钠溶液中加入盐酸酸化的氯化钡溶液,如果有白色沉淀生成就说明亚硫酸钠被氧化;氧气将硫化氢氧化生难溶性淡黄色沉淀S单质.
解答 解:(1)元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,a固体是碳酸钠,则a溶液应该是高氯酸,高氯酸和碳酸钠反应生成二氧化碳,故答案为:高氯酸;
(2)硝酸具有挥发性,所以生成的二氧化碳中含有硝酸,硝酸也能和硅酸钠反应生成白色沉淀,从而影响碳酸和硅酸钠的反应,所以该实验设计不合理,改进的措施是在通入b溶液之前通入饱和碳酸氢钠溶液除去稀硝酸,
故答案为:生成的二氧化碳中含有硝酸,硝酸也能和硅酸钠反应生成白色沉淀,从而影响碳酸和硅酸钠的反应;在b装置制取加入一个饱和碳酸氢钠溶液装置;
(3)向亚硫酸钠溶液中加入盐酸酸化的氯化钡溶液,如果有白色沉淀生成就说明亚硫酸钠被氧化,其检验方法为:取少量亚硫酸钠溶液于试管中,加入盐酸酸化的氯化钡溶液,如果产生白色沉淀就证明亚硫酸钠被氧化;氧气将硫化氢氧化生难溶性淡黄色沉淀S单质,所以看到的现象是烧杯中有淡黄色沉淀生成,
故答案为:取少量亚硫酸钠溶液于试管中,加入盐酸酸化的氯化钡溶液,如果产生白色沉淀就证明亚硫酸钠被氧化;烧杯中有淡黄色沉淀生成.
点评 本题考查性质实验方案设计,为高频考点,元素非金属性强弱判断可以根据最高价氧化物的水化物酸性强弱、氢化物的稳定性强弱、非金属单质的氧化性强弱等方法判断,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | t1℃时,100gKNO3饱和溶液中含有20g KNO3 | |
| B. | NaCl的溶解度不受温度的影响 | |
| C. | 温度高于t2℃时,KNO3的溶解度大于NaCl的溶解度 | |
| D. | t2℃时,KNO3的饱和溶液和NaCl的饱和溶液中溶质的质量分数不一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol/L | B. | 0.3 mol/L | C. | 0.2 mol/L | D. | 0.1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
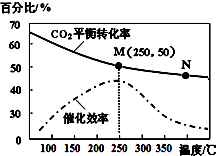 一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)$\stackrel{催化剂}{?}$CH2=CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )| A. | 该反应的逆反应为吸热反应 | |
| B. | 平衡常数:KM>KN | |
| C. | 生成乙烯的速率:v(N)一定大于v(M) | |
| D. | 当温度高于250℃,升高温度,催化剂的催化效率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40% | B. | 50% | C. | 80% | D. | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com