
| A. | 乙烯(C2H4)的电子式: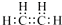 | B. | 丙烯(C3H6)的结构简式:CH2CHCH3 | ||
| C. | 立方烷(C8H8)的键线式: | D. | 溴乙烷(C2H5Br)的比例模型: |
分析 A.乙烯分子中碳碳以双键相连,碳剩余价键被H饱和,由此写出电子式;
B.丙烯的结构简式中没有标出其官能团碳碳双键;
C.键线式的特点以线示键,每个折点和线端点处表示有一个碳原子,并以氢原子补足四键,C、H原子不表示出来,据此分析;
D.比例模型主要体现的是组成该分子的原子间的大小关系;溴乙烷中含有2个C、5个H、1个Br.
解答 解:A.乙烯分子中碳碳以双键相连,碳剩余价键被H饱和,由此写出电子式为 ,故A正确;
,故A正确;
B.丙烯的官能团为碳碳双键,结构简式中需要标出官能团,丙烯的结构简式为CH3CH=CH2,故B错误;
C.立方烷(C8H8)的结构式: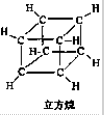 ,键线式:
,键线式: ,故C正确;
,故C正确;
D.溴乙烷(C2H5Br)含有2个C、5个H、1个Br,溴原子半径最大,所以其比例模型为 ,故D正确;
,故D正确;
故选B.
点评 本题考查了电子式、结构简式、键线式、比例模型的表示方法及判断,题目难度不大,注意掌握常见的化学用语的概念及正确的表示方法,有利于提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 海洋具有十分巨大的开发潜力,人民可以从海水中获得多种物质.
海洋具有十分巨大的开发潜力,人民可以从海水中获得多种物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )| A. | a为O2,b为CH4 | |
| B. | CO${\;}_{3}^{2-}$向正极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 正极电极反应式为2CO2+O2+4e-═2CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L醋酸溶液加水稀释,电离平衡正移,电离平衡常数增大 | |
| B. | 0.1mol/L醋酸溶液中加入锌粒,电离平衡正移,c(H+)增大 | |
| C. | 0.1mol/L醋酸钠溶液中加入醋酸钠固体,水解平衡正移,c(OH-)增大 | |
| D. | 在AgCl饱和溶液中加入AgCl固体,沉淀溶解平衡正移,c(Ag+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能与新制的Cu(OH)2悬浊液反应 | B. | 能发生加聚反应生成高分子化合物 | ||
| C. | 能与新制银氨溶液发生银镜反应 | D. | 与钠反应放出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com