
 X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子;Y原子核外的L层电子数是K层的两倍;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子.请回答下列问题:
X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子;Y原子核外的L层电子数是K层的两倍;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子.请回答下列问题:
分析 X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.X原子核外的M层中只有两对成对电子,外围电子排布为3s23p4,故X为S元素;Y原子核外的L层电子数是K层的两倍,L层电子数为4,则Y为C元素;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和,核外电子排布为1s22s22p4,故Z为O元素;M的内层电子数是最外层电子数的9倍,只能为第四周期元素,可推知M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,则Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数为2+8+18+1=29,故P为Cu,据此解答.
解答 解:X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素.X原子核外的M层中只有两对成对电子,外围电子排布为3s23p4,故X为S元素;Y原子核外的L层电子数是K层的两倍,L层电子数为4,则Y为C元素;Z元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和,核外电子排布为1s22s22p4,故Z为O元素;M的内层电子数是最外层电子数的9倍,只能为第四周期元素,可推知M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,则Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数为2+8+18+1=29,故P为Cu.
(1)P为Cu元素,属于ds区元素,Cu2+的核外电子排布式1s22s22p63s23p63d9,CO分子与氮气互为等电子体,二者结构相似,故CO电子式: ,
,
故答案为:ds;1s22s22p63s23p63d9; ;
;
(2)SO2分子中S原子价层电子对数为2+$\frac{6-2×3}{2}$=3,故VSEPR模型为平面三角形;
CO2分子中C原子形成2个σ键,没有孤对电子,碳原子杂化轨道类型为sp杂化;
H2O分子间能形成氢键,而H2S分子间不能形成氢键,故沸点H2O>H2S,
故答案为:平面三角形;sp;H2O分子间能形成氢键,而H2S分子间不能形成氢键;
(3)同周期随原子序数增大第一电离能呈增大强酸、同主族自上而下第一电离能减小,故第一电离能:S<O<F,
故答案为:S<O<F;
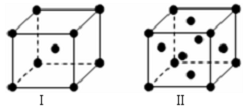
(5)N为K、P为Cu,K为体心立方堆积,晶胞结构为图I,Cu为面心立方堆积,晶胞结构为图Ⅱ,K的晶胞中原子数目为1+8×$\frac{1}{8}$=2,设该晶胞的密度为a g/cm3,阿伏加德罗常数的值为NA,N原子的摩尔质量为M,则晶胞体积为$\frac{\frac{2M}{{N}_{A}}g}{ag/c{m}^{3}}$=$\frac{2M}{a{N}_{A}}$cm3,设K原子半径为r,则(2r)2=3($\root{3}{\frac{2M}{a{N}_{A}}}$)2,故r=$\frac{3}{4}$$\root{3}{\frac{2M}{a{N}_{A}}}$,
故答案为:$\frac{3}{4}$$\root{3}{\frac{2M}{a{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、电子式、电离能、杂化方式、价层电子对互斥理论、等电子体、晶胞结构与计算等,是对物质结构主干知识的综合考查,(5)中注意涉及常见晶胞结构,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 .
.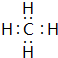 ,该化合物的二氯代物有1种.
,该化合物的二氯代物有1种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(Cl-),c(OH-)>c(H+) | B. | c(NH4+)=c(C1-),c(OH-)=c(H+) | ||
| C. | c(Cl-)>c(NH4+),c(OH-)>c(H+) | D. | c(C1-)>c(NH4+),c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ②③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | 氯化钡溶液 | C. | 氢氧化钡溶液 | D. | 氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 672mL | B. | 336mL | C. | 大于672mL | D. | 小于336mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入碘水中,反应的离子方程式为:SO2+I2+H2O═SO32-+2I-+2H+ | |
| B. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、A102- N03 - | |
| C. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 废易拉罐--可回收物 | B. | 废塑料瓶--其他垃圾 | ||
| C. | 废荧光灯管--有害垃圾 | D. | 不可再生废纸--可燃垃圾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com