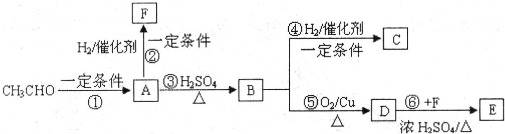
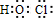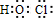·ÖĪö£ŗŅ»¶ØĢõ¼žĻĀ£¬ŅŅČ©·“Ӧɜ³ÉA£¬A·“Ӧɜ³ÉµÄBÄÜŗĶĒāĘų·¢Éś¼Ó³É·“Ó¦£¬ŌņAÖŠŗ¬ÓŠĖ«¼ü£¬AŌŚÅØĮņĖį×÷“߻ƼĮ”¢¼ÓČČĢõ¼žĻĀ·¢Éś·“Ӧɜ³ÉB£¬BÄÜŗĶĒāĘų·¢Éś¼Ó³É·“Ó¦£¬ĒŅB²»ŗ¬Ö§Į“£¬ŌņBŗ¬ÓŠĖ«¼ü£¬½įŗĻŅŃÖŖĢõ¼žÖŖ£¬Č©»łÖ®¼äÄÜ·¢Éś·“Ó¦£¬ĖłŅŌŅŅČ©ÖŠČ©»łÖ®¼ä·“Ӧɜ³ÉA£¬ŌņAµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
3CH£ØOH£©CH
2CHO£¬AŗĶĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉF£¬ŌņFµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
3CH£ØOH£©CH
2CH
2OH£¬ŌŚÅØĮņĖį×÷“߻ƼĮ”¢¼ÓČČĢõ¼žĻĀ£¬A·¢ÉśĻūČ„·“Ӧɜ³ÉB£¬ŌņBµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
2=CHCH
2CHO£¬BŗĶĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉC£¬ŌņCµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
3CH
2CH
2CH
2OH£¬ŌŚĶ×÷“߻ƼĮ”¢¼ÓČČĢõ¼žĻĀ£¬B±»ŃõĘųŃõ»ÆÉś³ÉD£¬ŌņDµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
2=CHCH
2COOH£¬ŌŚÅØĮņĖį×÷“߻ƼĮ”¢¼ÓČČĢõ¼žĻĀ£¬DŗĶF·¢Éśõ„»Æ·“Ӧɜ³ÉE£¬ŌņEµÄ½į¹¹¼ņŹ½ĪŖ£ŗ
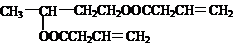
£¬ŌŁ½įŗĻĪļÖŹµÄŠŌÖŹ½ā“š£®
½ā“š£ŗ½ā£ŗŅ»¶ØĢõ¼žĻĀ£¬ŅŅČ©·“Ӧɜ³ÉA£¬A·“Ӧɜ³ÉµÄBÄÜŗĶĒāĘų·¢Éś¼Ó³É·“Ó¦£¬ŌņAÖŠŗ¬ÓŠĖ«¼ü£¬AŌŚÅØĮņĖį×÷“߻ƼĮ”¢¼ÓČČĢõ¼žĻĀ·¢Éś·“Ӧɜ³ÉB£¬BÄÜŗĶĒāĘų·¢Éś¼Ó³É·“Ó¦£¬ĒŅB²»ŗ¬Ö§Į“£¬ŌņBŗ¬ÓŠĖ«¼ü£¬½įŗĻŅŃÖŖĢõ¼žÖŖ£¬Č©»łÖ®¼äÄÜ·¢Éś·“Ó¦£¬ĖłŅŌŅŅČ©ÖŠČ©»łÖ®¼ä·“Ӧɜ³ÉA£¬ŌņAµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
3CH£ØOH£©CH
2CHO£¬AŗĶĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉF£¬ŌņFµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
3CH£ØOH£©CH
2CH
2OH£¬ŌŚÅØĮņĖį×÷“߻ƼĮ”¢¼ÓČČĢõ¼žĻĀ£¬A·¢ÉśĻūČ„·“Ӧɜ³ÉB£¬ŌņBµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
2=CHCH
2CHO£¬BŗĶĒāĘų·¢Éś¼Ó³É·“Ӧɜ³ÉC£¬ŌņCµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
3CH
2CH
2CH
2OH£¬ŌŚĶ×÷“߻ƼĮ”¢¼ÓČČĢõ¼žĻĀ£¬B±»ŃõĘųŃõ»ÆÉś³ÉD£¬ŌņDµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
2=CHCH
2COOH£¬ŌŚÅØĮņĖį×÷“߻ƼĮ”¢¼ÓČČĢõ¼žĻĀ£¬DŗĶF·¢Éśõ„»Æ·“Ӧɜ³ÉE£¬ŌņEµÄ½į¹¹¼ņŹ½ĪŖ£ŗ
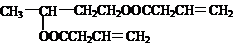
£¬
£Ø1£©AµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
3CH£ØOH£©CH
2CHO£¬Ęä·Ö×ÓŹ½ĪŖ£ŗC
4H
8O
2£¬BµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
2=CHCH
2CHO£¬
A£®BÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼üŗĶČ©»ł£¬ĖłŅŌ¼ČÄÜ·¢ÉśŃõ»Æ·“Ó¦ÓÖÄÜ·¢Éś»¹Ō·“Ó¦£¬¹ŹÕżČ·£»
B£®ÓėH
2·¢Éś¼Ó³É·“Ó¦Ź±£¬¼Ó³ÉĪ»ÖĆ²»Ķ¬ŌņÉś³ÉĪļ²»Ķ¬£¬¹Ź“ķĪó£»
C£®BÖŠŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬ĖłŅŌÄÜ·¢Éś¼Ó¾Ū·“Ӧɜ³Éøß¾ŪĪļ£¬¹ŹÕżČ·£»
D£®ÄÜŹ¹Br
2µÄĖ®ČÜŅŗĶŹÉ«£¬1moløĆÓŠ»śĪļ×ī¶ąÄÜŗĶ2mol Br
2·“Ó¦£¬¹Ź“ķĪó£»
¹Ź“š°øĪŖ£ŗC
4H
8O
2£¬CH
2=CHCH
2CHO£¬BD£»
£Ø2£©AµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
3CH£ØOH£©CH
2CHO£¬BµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
2=CHCH
2CHO£¬CµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
3CH
2CH
2CH
2OH£¬
A·“Ӧɜ³ÉBŹōÓŚĻūČ„·“Ó¦£¬B·“Ӧɜ³ÉCŹōÓŚ»¹Ō·“Ó¦»ņ¼Ó³É·“Ó¦£¬
¹Ź“š°øĪŖ£ŗĻūČ„·“Ó¦£¬»¹Ō£Ø»ņ¼Ó³É·“Ó¦£©£»
£Ø3£©ŌŚŅ»¶ØĢõ¼žĻĀ£¬ŅŅČ©·¢Éś·Ö×Ó¼ä·“Ó¦Éś³ÉCH
3CH£ØOH£©CH
2CHO£¬øĆ·“Ó¦·½³ĢŹ½ĪŖ£ŗ
2CH
3CHO
CH
3CH£ØOH£©CH
2CHO£¬¹Ź“š°øĪŖ£ŗ2CH
3CHO
CH
3CH£ØOH£©CH
2CHO£»
£Ø4£©CH
3CH£ØOH£©CH
2CH
2OHŗĶ CH
2=CHCH
2COOHŌŚÅØĮņĖį×÷“߻ƼĮ”¢¼ÓČČĢõ¼žĻĀ·¢Éśõ„»Æ·“Ӧɜ³Éõ„£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ
CH
3CH£ØOH£©CH
2CH
2OH+2CH
2=CHCH
2COOH
2H
2O+
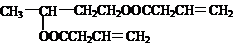
£»
¹Ź“š°øĪŖ£ŗCH
3CH£ØOH£©CH
2CH
2OH+2CH
2=CHCH
2COOH
2H
2O+
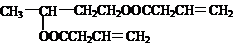
£»
£Ø5£©FµÄ½į¹¹¼ņŹ½ĪŖ£ŗCH
3CH£ØOH£©CH
2CH
2OH£¬ĘäĆū³ĘĪŖ£ŗ1£¬3-¶”¶ž“¼£¬G”śĖ³Ź½¾Ū1£¬3-¶”¶žĻ©µÄ·“Ó¦·½³ĢŹ½ĪŖ£ŗ
nCH
2=CH-CH=CH
2 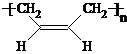
£¬
¹Ź“š°øĪŖ£ŗ1£¬3-¶”¶ž“¼£¬nCH
2=CH-CH=CH
2 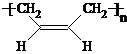
£»
£Ø6£©7.4g CµÄĪļÖŹµÄĮæ=
=0.1mol£¬Óė×ćĮ潚ŹōNa·“Ó¦£¬Éś³ÉĒāĘųµÄĢå»ż=
”Į22.4L/mol=1.12L£¬¹Ź“š°øĪŖ£ŗ1.12£»
£Ø7£©¢ŁÄܹ»·¢ÉśĖ®½ā·“Ó¦£¬ĖµĆ÷ŗ¬ÓŠõ„»ł£»¢ŚÄܹ»·¢ÉśŅų¾µ·“Ó¦£¬ĖµĆ÷ŗ¬ÓŠČ©»ł£»¢Ū·ĒĆŃĄąĪļÖŹ£¬ĖµĆ÷ŃõŌ×Ó²»ŹĒ“¦ÓŚĮ½øöĢ¼Ō×ÓÖ®¼ä£¬ĖłŅŌAµÄĶ¬·ÖŅģ¹¹ĢåµÄ½į¹¹¼ņŹ½ĪŖ£ŗHCOOCH
2CH
2CH
3£¬HCOOCH£ØCH
3£©
2£¬
¹Ź“š°øĪŖ£ŗHCOOCH
2CH
2CH
3£¬HCOOCH£ØCH
3£©
2£®

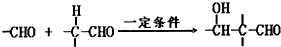
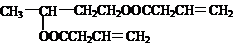
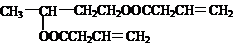
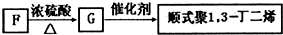
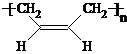
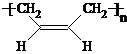
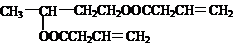 £¬ŌŁ½įŗĻĪļÖŹµÄŠŌÖŹ½ā“š£®
£¬ŌŁ½įŗĻĪļÖŹµÄŠŌÖŹ½ā“š£®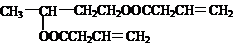 £¬
£¬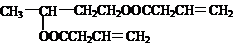 £»
£»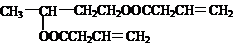 £»
£»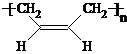 £¬
£¬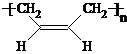 £»
£»

 ŌĘÄĻŹ¦“óø½Š”Ņ»ĻßĆūŹ¦ĢįÓÅ×÷ŅµĻµĮŠ“š°ø
ŌĘÄĻŹ¦“óø½Š”Ņ»ĻßĆūŹ¦ĢįÓÅ×÷ŅµĻµĮŠ“š°ø
 £Ø2012?ŗÓ¶«ĒųŅ»Ä££©A”¢B”¢C”¢D”¢EĪåÖÖŌŖĖŲ“Ó×óĻņÓŅ°“ŌÓčŠņŹżµŻŌö£ØŌ×ÓŠņŹżĪŖ5øöĮ¬ŠųµÄ×ŌČ»Źż£©µÄĖ³ŠņÅõĮŠČēÓŅ£ŗĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
£Ø2012?ŗÓ¶«ĒųŅ»Ä££©A”¢B”¢C”¢D”¢EĪåÖÖŌŖĖŲ“Ó×óĻņÓŅ°“ŌÓčŠņŹżµŻŌö£ØŌ×ÓŠņŹżĪŖ5øöĮ¬ŠųµÄ×ŌČ»Źż£©µÄĖ³ŠņÅõĮŠČēÓŅ£ŗĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©