
【题目】钒(23V)被称为“现代工业味精”,可添加在钢铁中,并以钛-铝-钒合金的形式用于航天领域;钒的化合物被广泛用作催化剂、燃料及电池等。我国钒钛磁铁矿储量较大,是世界上产钒大国。请完成下列问题:
(1)钒的基态原子的外围电子排布式为_____。
(2)钒的某种氧化物的晶胞结构如下图1所示,则该氧化物的化学式为________,其熔沸点比下图3(为邻苯二甲酸酐的结构)物质的熔沸点要________(填“高”、“低”或“差不多”)。
(3)V2O5是一种常见的催化剂,在合成硫酸、硝酸、邻苯二甲酸酐、乙烯、丙烯中,均使用五氧化二钒作催化剂。

①五氧化二钒的结构简式如上图2所示,则该结构中含有_______个π键。
②在丙烯(CH3CH=CH2)分子中碳原子的杂化方式分别为__________。
③H、C、N、O四元素,其电负性从大到小的顺序依次为___________________。
④V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。列举与![]() 空间构型相同的一种阳离子:________(填离子符号)。
空间构型相同的一种阳离子:________(填离子符号)。
(4)已知单质钒的晶胞如上图5所示,假设晶胞的边长为d×10—7cm,钒的相对原子质量为M,则密度为__________g·cm-3。(设阿伏加德罗常数为NA)
【答案】3d34s2 VO2 高 4 sp3、sp2 O>N>C>H ![]()
![]()
【解析】
(1)钒是23号元素,根据能量最低原理写出外围电子排布式;
(2)根据均摊法计算晶胞中V、O原子数目,进而确定化学式。VO2 是离子晶体,其熔沸点比分子晶体邻苯二甲酸酐的熔沸点要高。
(3)①单键为σ键,双键含有1个σ键、1个π键;
②甲基上的碳形成4个σ键,为sp3、双键上的碳形成3个σ键,一个π键,为sp2杂化;
③非金属性越强,电负性越大;
④形成4个σ键,没有孤对电子的粒子;
(4)结合原子数目表示出晶胞质量,再根据ρ=m/V计算晶胞密度。
(1)钒的基态原子的外围电子排布式为3d34s2 ;
(2)由晶胞结构可知,含钒原子8×1/8+1=2,O为4×1/2+2=4,该氧化物的化学式为VO2 ,VO2 是离子晶体,其熔沸点比分子晶体邻苯二甲酸酐的熔沸点要高。
(3)①由五氧化二钒的结构图:单键为σ键,双键含有1个σ键、1个π键,可得出含有4个π键。
②在丙烯(CH3CH=CH2)分子中碳原子的杂化方式分别为:甲基上的碳形成4个σ键,为sp3、双键上的碳形成3个σ键,一个π键,为sp2杂化。
③非金属性越强,电负性越大;H、C、N、O四元素,其电负性从大到小的顺序依次为O>N>C>H。
④形成4个σ键,没有孤对电子的粒子,与![]() 空间构型相同的一种阳离子:NH4+。
空间构型相同的一种阳离子:NH4+。
(4)晶胞中钒原子个数为8×1/8+1=2,假设晶胞的边长为d×10—7cm,钒的相对原子质量为M,则密度为ρ=m/V=![]() g·cm-3。
g·cm-3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化工厂利用甲烷与氯气反应得到的副产品来制取盐酸实现了变废为宝的梦想,其生产原理可在实验室中模拟如下,请根据要求填空:

(1)写出装置A中发生反应的化学方程式_____;
(2)B装置的三种功能是①干燥混合气体,②使气体混合均匀,③_____;
(3)设![]() =x,若理论上欲获得最多的氯化氢,则x值应___;
=x,若理论上欲获得最多的氯化氢,则x值应___;
(4)在C装置中,经过一段时间的强光照射后,发现硬质玻璃管内壁附着有油珠,写出生成产物中密度最大的物质的化学方程式___;
(5)D装置的作用是___(填编号);
A.收集气体 B.吸收氯气 C.防止倒吸 D.吸收氯化氢
(6)该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为_____(填编号)。
①CH4 ②CH3Cl ③CH2Cl2 ④CHCl3 ⑤CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列日常生活中涉及到一些化学知识分析正确的是
A.铝在空气中耐腐蚀,所以铝是不活泼金属
B.大力开发化石能源以推动经济发展
C.积极推广共享单车以减少雾霾和光化学烟雾
D.焰火的五彩缤纷是某些金属元素化学性质的呈现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,改变饱和氯水的pH,得到部分含氯微粒的物质的量分数与pH的关系如图所示。下列叙述不正确的是
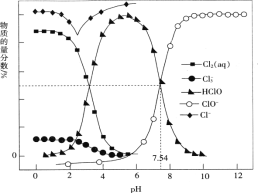
A. 氯水中的Cl2、ClO-、HClO均能与KI发生反应
B. 常温下反应Cl2(aq)+Cl-(aq)![]()
![]() (aq)的K=0.191,当pH增大时,K减小
(aq)的K=0.191,当pH增大时,K减小
C. pH=1的氯水中,c(Cl2)>c(![]() )>c(HClO)>c(ClO-)
)>c(HClO)>c(ClO-)
D. 该温度下,HClO![]() H++ClO-的电离常数Ka的对值lgKa=-7.54
H++ClO-的电离常数Ka的对值lgKa=-7.54
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存且溶液为无色透明的离子组是
A.Ag+、NO3–、Cl–B.Na+、Fe3+、NO3–
C.K+、Cl–、HCO3–D.Mg2+、Cl–、SO42–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在周期表中所处的位置如图所示。A、B、C三种元素原子的质子数和为32。D元素原子的最外层电子数是其次外层电子数的2倍。则下列说法正确的是

A. 元素D的某种同位素质量数为14,则其中子数为6
B. 四种元素形成的气态氢化物中,C元素的氢化物的稳定性最强
C. B、C两种元素可形成BC6型化合物,该化合物属于离子化合物
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据分子结构与性质相关知识,回答下列问题:
(1)NH3分子的VSEPR模型为______________;SO2分子的立体构型为:_______________;
(2)根据等电子原理,写出CN-的电子式_______;SCN-中心原子的杂化方式为 ________;
(3)向CuSO4溶液中逐渐滴加氨水至过量,现象为:__________________________;写出该过程中依次发生的反应离子方程式:_________________________,并写出[Cu(NH3)4]2+的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,小火均匀地加热3—5min。
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层。
④分离出乙酸乙酯层、洗涤、干燥。
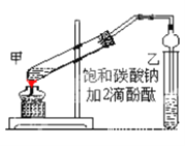
(1)若实验中用乙酸和含18O的乙醇作用,该反应的化学方程式是:________________________;与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是________________________。
(2)甲试管中,混合溶液的加入顺序:________________________;
(3)步骤②中需要用小火均匀加热,其主要原因是____________________________________;
(4)上述实验中饱和碳酸钠溶液的作用是____________(填字母代号)。
A. 反应掉乙酸和乙醇
B. 反应掉乙酸并吸收乙醇
C. 乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D. 加速酯的生成,提高其产率
(5)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器是____________;分离时,乙酸乙酯应该从仪器____________(填:“下口放”或“上口倒”)出。
(6)生成乙酸乙酯的反应是可逆反应,反应一段时间后,下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有____________(填序号)。
①混合物中各物质的浓度不再变化;
②单位时间里,生成1mol乙醇,同时生成1mol乙酸;
③单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸。
(7)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的 厚度/cm |
A | 2mL乙醇、1mL乙酸、3mL 18mol·L1浓硫酸 | 饱和Na2CO3溶液 | 3. 0 |
B | 2mL乙醇、1mL乙酸、3mL H2O | 0. 1 | |
C | 2mL乙醇、1mL乙酸、3mL 2mol·L1 H2SO4 | 0. 6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0. 6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是_________mL和________mol·L1。
②分析实验_________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(8)若现有乙酸90g,乙醇138g发生酯化反应得到88g乙酸乙酯,试计算该反应的产品产率为。___________(产率%=(实际产量/理论产量)×100%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com