
����Ŀ����ͼ����ѧ��ѧ�г������ʵ�ת����ϵ���������ʺͷ�Ӧ������ȥ��
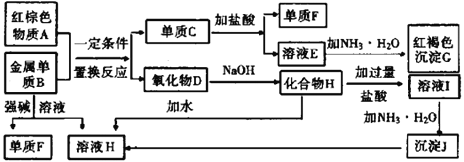
��1������Ѻ���ɫ����A���ɺ�ɫ���Ծ��壬�Ʋ��������������ȫһ�µģ���д����ɫ���Ծ�����������ᷴӦ�Ļ�ѧ����ʽ_______________________________��
��2��д������B��ǿ����Һ��Ӧ�����ӷ���ʽ��_______________________________������Һ���е���������ȫת��Ϊ����JΪʲô�Ӱ�ˮ��������������_______________��
��3����ҺE�м��백ˮʱ�������ɰ�ɫ����L��д������L�����ӷ���ʽ��_________________________����ɫ����L���ձ�Ϊ���ɫ����G��д��L��ΪG�Ļ�ѧ��Ӧ����ʽ_________________________��
��4������E��Һʱ��ΪʲôҪ���뵥��C�������ӷ���ʽ����_____________________________��
���𰸡� Fe3O4+8HCl=2FeCl3+FeCl2+4H2O 2Al+ 2OH��+ 2 H2O = 2 AlO2��+ 3 H2�� ��Ϊ��������������������ǻ�����ǿ�� Fe2++2NH3��H2O==Fe(OH)2��+2NH4+ 4Fe(OH)2+O2+2H2O=4Fe(OH)3 Fe + 2Fe3+ = 3Fe2+
������������ɫ����AΪFe2O3�����������B��Ӧ����������D�͵���C����÷�Ӧ�����ȷ�Ӧ������B��Al��C��Fe��������D����NaOH��Ӧ��ӦΪAl2O3��HΪNaAlO2��H������Ԫ�ط�Ӧ����I����IΪAlCl3���Ȼ����백ˮ��Ӧ���ɰ�ɫ����J��JΪAl(OH)3�����������ᷴӦ�����������Ȼ���������FΪH2��EΪFeCl2���Ȼ������백ˮ��Ӧ�������ɺ��ɫ����G����GΪFe(OH)3����1����ɫ���Ծ���Ϊ��������������������ᷴӦ�Ļ�ѧ����ʽΪFe3O4+8HCl=2FeCl3+FeCl2+4H2O����2��Al���������Ƶ�ǿ����Һ��Ӧ������������Ӧ�����ӷ���ʽΪ2Al+ 2OH��+ 2 H2O = 2 AlO2��+ 3 H2������Ϊ��������������������ǻ�����ǿ���Ӧ�����ӷ���ʽΪAl(OH)3+OH-��AlO2-+2H2O����3���Ȼ������백ˮ��Ӧ������������������Ӧ�����ӷ���ʽΪFe2++2NH3��H2O==Fe(OH)2��+2NH4+��Fe(OH)2���ȶ����ڿ����б���������ɫ����Ѹ�ٱ�ɻ���ɫ�����ձ�Ϊ���ɫFe(OH)3����Ӧ�Ļ�ѧ����ʽΪ4Fe(OH)2+O2+2H2O=4Fe(OH)3����4������FeCl2��Һʱ��Ҫ���뵥��Fe����ֹ����Fe + 2Fe3+ = 3Fe2+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһ��̬������һ��̬��ϩ����ɵĻ�����壬��ͬ��ͬѹ�¶�����������ܶ�Ϊ13����״���½��˻������29.12Lͨ��������ˮ�У���ˮ����������21.0g��
��1����������е���̬�����ǣ�
��2����������е�ϩ���ķ���ʽ�ǣ���ṹ��ʽ�ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ұ������һ�����������ַ������ٽ�̿������ˮú��(��������һ����̼)�����ۻ��ý����û������ܵ�ⷨ�����ַ����ڹ�ҵ�Ͼ���Ӧ�ã��Ŵ���(1)���տ�ȸʯ��ͭ��(2)ʪ����ͭ���ִ���(3)���ȷ�������(4)�ӹ�±ʯ(KCl��MgCl2��6H2O)����þ�������ǵ�ұ�������ķ�������ȷ����( )
A.(1)�â�B.(2)�â�C.(3)�â�D.(4)�â�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ʊ�H2O2��һ�ֻ����Ѻ����Ʊ�������װ����ͼ��ʾ������˵���������
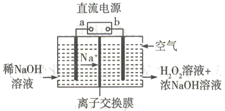
A. bΪֱ����Դ�ĸ���
B. ��װ��ʹ�õĽ���ĤΪ�����ӽ���Ĥ
C. ͨ������ĵ缫��Ӧʽ����ΪO2+2e-+2H2O=H2O2+2OH-
D. ������17g˫��ˮ������Ҫͨ�뺬11.2 LO2 �Ŀ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش�����������
��1�������������ļ��������������з��������ٵ���________________����״���������С����_____________________��
��1gH2 ��2.408��1023��CH4���� ��10.8gH2O ����״����6.72LCO2
��2������ƽ����ʽ��___KClO3+____HCl��Ũ��=___KC1+____ ClO2��+___Cl2��+__H2O��__________
��3����Һ��������ȡ���������ƶ����ӵ�Ũ�Ⱥ����������������Ũ��Խ�����������Խ�࣬��Һ��������Խǿ������Ũ�Ⱦ�Ϊlmol/L�����µ������Һ����K2CO3 ��AgNO3 ��NaHSO4 ��Al2(SO4)3��H2SO4 ��Ba(OH)2����Щ��Һ�е���������ǿ����__________���������������������������____________��
��4����12.4gNa2R��Na+Ϊ0.4mol����Na2R��Ħ������Ϊ____________��
��5����0.2L��NaCl��Һ��MgCl2��Һ��CuCl2��Һ��ɵĻ����Һ�У��������ӵ�Ũ����ͼ��ʾ���û����Һ��CuCl2�����ʵ���Ũ��Ϊ____________ molL-1��

��6����ͼ��ʾ�ľ�ʾ��־����һ��____________����ѡ���������

A.��ȼƷ B.�綾Ʒ C.��ʴƷ D.��ըƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧѧϰ��ʹ������ı�ʾ��������ֱ�ۡ������Ч��,���б����в���ȷ����( )
A. ��������Һ��pH������ԵĹ�ϵ: ![]()
B. Fe��Cl2�е�ȼ�ղ���: 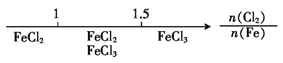
C. ��Ļ������л��ϼ����������ԡ���ԭ�ԵĹ�ϵ: 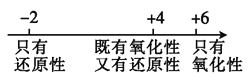
D. ��ˮ��SO2��Ӧ����Һ�е����: 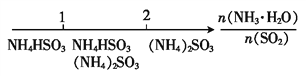
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������RO4n-�й���x��������ӣ�Rԭ�ӵ�������ΪA����Rԭ�Ӻ��ں����ӵ���Ŀ
A.A+n+32-xB.A+n-24-xC.A-n+24-xD.A+n+24-x
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ�����ӷ���ʽ������ȷ���ǣ� ��
A.CH3COONa����Һ��CH3COO��+H2O�TCH3COOH+OH��
B.NH4Cl����Һ��NH ![]() +H2O?NH3?H2O+H+
+H2O?NH3?H2O+H+
C.Na2CO3����Һ��CO ![]() +H2O?H2CO3+2OH��
+H2O?H2CO3+2OH��
D.AlCl3����Һ��Al3++3H2O�TAl��OH��3��+3H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƕ�Ԫ��ǿ��������������Һ�����ԡ������£���10 mL 0.01 mol/LNaHC2O4��Һ�еμ�0.01 mol/L NaOH��Һ������NaOH��Һ��������ӣ���Һ������Ũ�ȹ�ϵ��ȷ����
A. V��NaOH��=0ʱ��c��H+��=1��10-2mol/L
B. V��NaOH����10mLʱ�������ܴ���c��Na+��=2c��C2O42-��+c��HC2O4-��
C. V��NaOH��=10mLʱ��c��H+��=1��10-7mol/L
D. V��NaOH����10mLʱ��c��Na+����c��C2O42-����c��HC2O4-��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com