
【题目】在一支25mL的滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL刻度处。若把滴定管内溶液全部放入烧杯中,再用0.1mol/L NaOH溶液进行中和,所需NaOH溶液的体积为( )
A.大于20mLB.小于20mLC.等于20mLD.等于5mL
科目:高中化学 来源: 题型:
【题目】室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是
A.通入少量HCl气体 B.加入少量NaOH固体
C.加入少量H2O D.适当升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 某温度Ksp(Ag2S)=6![]() 10-50(mol·L-1)3,Ksp(AgCl)=2
10-50(mol·L-1)3,Ksp(AgCl)=2![]() 10-6(mol·L-1)2,则2AgCl(g)+S2-(aq)
10-6(mol·L-1)2,则2AgCl(g)+S2-(aq) ![]() Ag2S(s)+2Cl-(aq)的平衡常数约为6.7
Ag2S(s)+2Cl-(aq)的平衡常数约为6.7![]() 1037mol·L-1
1037mol·L-1
B. pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<①
C. pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1
D. 一定浓度的NaHS溶液在:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应表达正确的是( )
A. 1-丙醇与浓氢溴酸反应: CH3CH2 CH2OH + HBr ![]() CH3CH2 CH2Br + H2O
CH3CH2 CH2Br + H2O
B. 服用阿司匹林过量出现水杨酸(![]() )中毒反应, 可静脉注射 NaHCO3溶液:
)中毒反应, 可静脉注射 NaHCO3溶液:
![]() + 2 HCO3-→
+ 2 HCO3-→![]() + 2 CO2↑ + 2 H2O
+ 2 CO2↑ + 2 H2O
C. 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-![]() CH2BrCOO-+H2O
CH2BrCOO-+H2O
D. 向丙氨酸钠中加入足量盐酸:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
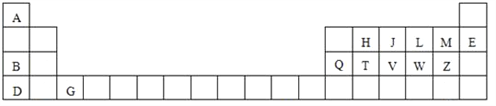
(1)原子半径最大的元素是_______;在化合物中只有负价的元素是 _______;属于副族元素是_______;适合作半导体材料的是_______,(只用表中的字母填写)
(2)V在周期表中的位置第_______周期第_______族。.
(3)M原子基态电子排布式为___________________________________。
L原子基态电子排布图为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH1=-1452.8 kJ·mol-
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________。
(2)下图1是采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池。电池工作过程中负极反应式为__________________________。

(3)一种含锰磁性材料的单晶胞结构为立方晶胞,如图2所示。A、B位置的Sn原子坐标如图所示,则该晶胞中碳原子的原子坐标为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对Na2S03与AgN03在不同pH下的反应进行探究
(1)测得Na2S03溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是__________;
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
②Ag2O棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为 。
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为 。
该同学设计实验确认了 a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀, 置于Na2SO3溶液中,沉淀溶解。另取Ag2SO4固体置于足量 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向x中加人过量浓HNO3,产生红棕色气体。
Ⅲ.用 Ba(NO3)2 溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是 。
②根据实验现象,分析X是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,+4价硫的还原性增强,能被+1价银氧化。通过进一步实验确认了这种可能性,实验如下:

①通人Y后,瓶中白色沉淀转化为棕黑色,气体Y是 。
②白色沉淀转化为X的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中下列各物质间不能实现![]() (“→”表示一步完成)转化的是:
(“→”表示一步完成)转化的是:
A | B | C | D | |
a | CH3CH2OH | CH2===CH2 | 硬脂酸 | HCOOCH3 |
b | CH3CHO | CH3CH2Br | 硬脂酸甘油酯 | CH3OH |
c | CH3COOH | CH3CH2OH | 硬脂酸钠 | HCOOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。
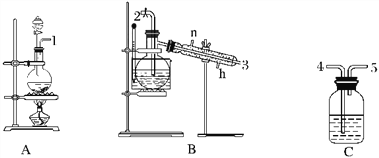
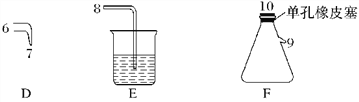
NCl3的相关性质如下:
物理性质 | 制备原理 | 化学性质 |
黄色油状液体,熔点为-40 ℃,沸点为71 ℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g·mL-1 | Cl2与NH4Cl水溶液在低温下反应 | 95 ℃爆炸,热水中能与水反应 |
回答下列问题:
(1)根据实验目的,接口连接的顺序为1→____________________________________。
(2)C装置作用是_________________________________________________________________。
(3)B装置中发生反应的化学方程式为____________________________________,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为________________。
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50~60 ℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com