
��15�֣�����������(Na2S2O5)�dz��õ�ʳƷ��������֮һ��ij�о�С���������ʵ�飺
ʵ��һ ���������Ƶ���ȡ
������ͼװ��(ʵ��ǰ�ѳ���װ���ڵĿ���)��ȡNa2S2O5��װ�â�����Na2S2O5���������������ķ�ӦΪ��Na2SO3��SO2��Na2S2O5

��1��װ�â��в�������Ļ�ѧ����ʽΪ ��
��2��Ҫ��װ�â��л���������ľ��壬�ɲ�ȡ�ķ��뷽���� ��
��3��װ�â����ڴ���β������ѡ�õ������װ��(�г���������ȥ)Ϊ (�����)��

ʵ��� ���Ѿ��п��������������IJⶨ
��4�����ѾƳ���Na2S2O5�������������ⶨij���Ѿ��п��������IJ�����(������SO2����)�ķ������£�

(��֪���ζ�ʱ��Ӧ�Ļ�ѧ����ʽΪSO2��I2��2H2O��H2SO4��2HI)
�ٰ���������ʵ�飬���ı�I2��Һ25��00 mL���ô�ʵ������Ʒ�п��������IJ�����(������SO2����)Ϊ g��L��1��
��������ʵ������У����в���HI���������������ý�� (�ƫ�ߡ���ƫ�͡����䡱)��
��1��Na2SO3+H2SO4��Na2SO4+SO2��+H2O��Na2SO3+2H2SO4��2NaHSO4+SO2��+H2O
��2������ ��3��d ��4����0��16 ��ƫ��
��������
�����������1��װ��I������ȡ��������ķ�Ӧ��Ũ�������������Ʒ�Ӧ���ɶ������������ơ�ˮ����ѧ����ʽΪNa2SO3+H2SO4��Na2SO4+SO2��+H2O��Na2SO3+2H2SO4��2NaHSO4+SO2��+H2O��
��2��װ�â�����Na2S2O5�������������Դ�װ��II�еõ�����ķ����ǹ��ˣ�
��3��װ��III����β����β���ijɷ��Ƕ���������������������Һ���գ����ŵ����θ������ɷ�ֹ���������Դ�ѡd��
��4���ٸ���SO2��I2��2H2O��H2SO4��2HI��֪��SO2��I2�����Ը������ĵ�����ʵ����ɼ�����������������0��025L��0��01mol/L��64g/mol=0��016g�����Ըô�ʵ������Ʒ�п��������IJ�������0��016g/0��1L=0��16g/L��
��������ʵ������У����в���HI������������������ĵĵⵥ�ʵ����ʵ������٣����Բⶨ���ƫ�͡�
���㣺�������������ȡ�������������IJⶨʵ�����������㣬����ʵ��������жϣ����ķ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ�߶���ѧ������������ѧ���ģ��Ծ��������棩 ���ͣ�?????
��KSCN��Һ���뵽������ָ������Һ�У���Һ�����Ժ�ɫ����
A���������������ۺ��FeCl3��Һ
B����˿������������ȼ�պ����ò����ˮ��Һ
C�����ڱ�¶�ڿ����е��̷���Һ
D��������ˮ���FeCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ��ͷ�и�һ��ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д�ɻ�ѧ����ʽ��ȷ����
A��Cu2+ + 2OH- = Cu(OH)2�� CuSO4+Ba(OH)2= Cu(OH)2��+ Ba2SO4��
B��CO32- + 2H+ = CO2��+ H2O NaHCO3 + HCl =NaCl+ CO2��+ H2O
C��H+ +OH- = H2O NaOH+HNO3=NaNO3+H2O
D��SO42-+Ba2+=BaSO4�� BaCl2+H2SO4=BaSO4��+2HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡ��ͷ�и�һ��ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���������У�����������������Һ������Ӧ����
A��Mg B��Al(OH)3 C��Al D��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�갲��ʡ����ʮУ������ѧ����ĩ�������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��H2Sͨ��FeCl3 ��Һ�У����˺�ӦҺ��������е��(����ͼ��ʾ)�������Һ������ѭ�����á��÷��������ڴ���ʯ�����ƹ����в�����H2S������

�����й�˵����ȷ����
A�����˵õ��ij���������FeS��S
B������0.20mol�ĵ���ת�ƣ�һ���ܵõ�2.24L������
C��������Fe����ӵ�Դ��a������
D����a�������ĵ缫��ӦΪFe2����2e��=Fe3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������ʡ�������и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����������þƾ���ֱ�Ӽ��ȵ���
A����ƿ B������ƿ C���Թ� D����ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������ʡ�������и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ӷ���ʽ��д��ȷ����
A������ͨ��ˮ��H2O+ Cl2 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B���Ȼ�����Һ�м�������2Fe3+ + Fe 3Fe2+
3Fe2+
C��̼��Ƽ��������� C032-+2H+��CO2��+H2O
D��ͭƬ����ϡ������Cu + 2 H+ = Cu2++H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�����ʡ�����и���Ԫ�µ������ۻ�ѧ�Ծ��������棩 ���ͣ������
ѡ���⡾��ѧһһѡ��ѧ�뼼������15�֣�����п�̳�����Ҫ�ɷ�ΪZnO��������CuO��FeO��Ϊԭ�ϣ�������ȡ�Ȼ�п�ͽ���п��
����ȡ�Ȼ�п��Ҫ�������£�
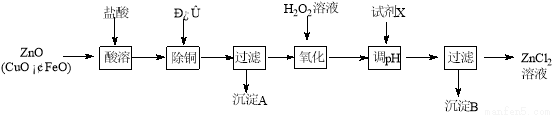
�±��г�����ؽ������������������������pH (��ʼ������pH����������Ũ��Ϊ1.0 mol��L��1����)��
�������� | ��ʼ������pH | ������ȫ��pH |
Fe3+ | 1. 1 | 3. 2 |
Zn2+ | 5. 2 | 6. 4 |
Fe2+ | 5. 8 | 8. 8 |
��1������H2O2��Һ������Ӧ�����ӷ���ʽΪ ��
��2������ͼ�У�Ϊ�˽�����Һ����ȣ��Լ�X�������� ��ѡ����ţ�
a��ZnO��b��Zn(OH)2 ��c��Zn2(OH)2CO3 ��d��ZnSO4��pHӦ������ ��
��3���Ȼ�п�ܴ����ᣨ2���ǻ����ᣩ���ɱ�������C6H8O4���;����ᣬ�������Ľṹ��ʽΪ ��������Ľṹ��ʽΪ ��
����ȡ����п���ü��ܽ�ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq)��Ȼ�����ȡҺ��
��4����ʯī���缫���ʱ����������������Ϊ �������ĵ缫��ӦΪ ��
��5����п�̳����ü��ܣ������������ܺ��⣬��Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�����и���һ�»�ѧ�Ծ��������棩 ���ͣ�ѡ����
0.44 gͭþ�Ͻ���ȫ�ܽ���100 mL�ܶ�Ϊ1.40 g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������336 mL(��״��)����Ӧ�����Һ�м���1.0 mol/L NaOH��Һ������������ȫ������ʱ���õ�0.78 g����������˵����ȷ����
A���úϽ���ͭ��þ��������֮����2��1
B����Ũ������HNO3�����ʵ���Ũ����7.0 mol/L
C��NO2��N2O4 �Ļ�������У�NO2 �����������80%
D���õ�0.78 g����ʱ������NaOH��Һ�������1380mL
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com