
下列叙述不正确的是 ( )
| A.若周期表中第七周期完全排满共有32种元素 |
| B.周期表中共有18个列,其中形成化合物种类最多的在第14列 |
| C.在氯化钠和氯化铯晶胞中阳离子的配位数分别为8和6 |
| D.在二氧化碳晶胞中每个二氧化碳分子周围紧邻二氧化碳分子有12个 |
C
解析试题分析:A.元素周期表中各周期包含的元素中数分别是2、8、8、18、18、32、32。周期表中第七周期完全排满共有32种元素。正确。B.周期表中共有18个列,第14列元素是第四主族的元素,容易形成共价化合物,所以形成化合物种类最多。正确。C.在氯化钠晶体的配位数是6,氯化铯晶体的的配位数分8。错误。D.二氧化碳晶体是立方面心结构。在晶胞中每个二氧化碳分子周围紧邻二氧化碳分子在一个晶胞中有3个,而通过每个二氧化碳分子能形成8个晶胞。每个二氧化碳分子都计算了2次,所以二氧化碳晶胞中每个二氧化碳分子周围紧邻二氧化碳分子有(3×8)÷2=12个.正确。
考点:考查晶体结构和元素周期表的结构及包含的元素种类的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
已知A、B、C均为短周期的元素,A、B同周期,A、C的最低价离子分别为A2- 和C—,B2+和C—具有相同的电子层结构,下列说法正确的是
A.离子半径:A2->C—>B2+ B.C元素的最高正价一定为+7价
C.对应气态氢化物的稳定性A>C D.还原性:A2-<C-
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是 ( )
A.Na的结构示意图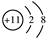 |
| B.多电子原子中,在离核较远区域运动的电子能量较低 |
| C.非金属元素组成的化合物中可能有共价键和离子键 |
| D.HF、HCl、HBr、HI的热稳定性和还原性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图3中每个“·”代表一种元素,其中O点代表氢元素。下列说法中错误的是 
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B元素是图中金属性最强的元素
D.A、B组成的化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列排列的顺序正确的是
| A.热稳定性:HCl>PH3>H2S | B.碱性:NaOH< Mg(OH)2<Al(OH)3 |
| C.原子半径:O>S>Na | D.结合氢离子能力:CO32->HCO3->SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是( )
| A.原子半径:Z>R>W |
| B.XW4分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将甲、乙两种金属的性质相比较,已知①甲跟水反应比乙跟水反应剧烈;②甲单质能从乙的盐溶液中置换出乙单质;③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;④与某金属反应时甲原子得电子数目比乙的多;⑤以甲、乙两金属为电极构成原电池,甲作负极。能说明甲的金属性比乙强的是( )
| A.①②③ | B.③⑤ | C.①②③⑤ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
| | R | | |
| T | Q | | W |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z和W的原子序数依次增大。X原子的S能级电子总数是P能级电子总数的2倍,Y与X同主族,Z和W原子中未成对电子数之比为2∶1。下列说法错误的是( )
| A.XW4为非极性分子 |
| B.Y、Z、W的最高价氧化物的水化物酸性强弱顺序是Y<Z<W |
| C.X、Y的氢化物由固态转化为气态时,克服相同的作用力 |
| D.XW4、YW4、ZW2分子中的中心原子均为sp杂化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com