
某溶液中 、
、 、
、 的物质的量之比为1∶2∶3,通入一定量的
的物质的量之比为1∶2∶3,通入一定量的 充分反应后,该比值变为3∶2∶1,则反应的
充分反应后,该比值变为3∶2∶1,则反应的 与原溶液中的
与原溶液中的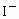 的物质的量之比为
的物质的量之比为
[ ]
科目:高中化学 来源: 题型:阅读理解
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
现 象 |
| ① | 第一份CuSO4溶液 | a | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | b | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由蓝色变为深绿色 |
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
现 象 |
| ① | d | 第一份NaBr溶液 | 溶液由蓝色变为蓝绿色 |
| ② | e | 第一份NaBr溶液 | 溶液由蓝色变为草绿色 |
| ③ | f | 第一份NaBr溶液 | 溶液由蓝色变为深绿色 |
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
温度 | 现象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由蓝色变为深绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.1 | 8.8 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 化学式 | Fe | FeO | Fe2O3 | Fe3O4 | Fe(OH)2 | Fe(OH)3 |
| 颜色 | 银白色 | 黑色 | 红色 | 黑色 | 白色 | 红褐色 |
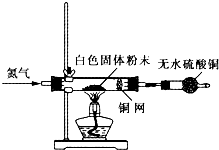
查看答案和解析>>
科目:高中化学 来源: 题型:
(6分)、(1)如下图横坐标为某溶液中加入溶质的物质的量,纵坐标为生成沉淀的量,若向硫
酸铝溶液中加入氢氧化钠溶液至过量,沉淀的变化符合A~C中的________
(2)现向1mol/L 100ml的AlCl3溶液中加入一定浓度的NaOH溶液100ml,充分反应后,得到3.9g沉淀,则NaOH溶液的物质的量浓度为________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com