
����Ŀ�������ڹ�ҵ��������Ҫ����;��ij��ȤС����ʵ������ģ�ҵ���������Ʊ���ˮ�Ȼ�������ˮAlCl3(183������)����ʪ������������������������������װ���Ʊ���

��1��װ��B��ʢ��____��Һ��C��F��װ����ͬһ���Լ������Լ�Ϊ________________��
��2��װ��A��Բ����ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_______________________________��
��3��ʵ�鲽������ͼ����װ�ú��ȼ���װ������������װҩƷ��Ȼ���ȼ___________(����A������C��)���ƾ��ƣ���____����ʵ��������ʱ���ٵ�ȼ___________(����A������C��)���ƾ��ơ�
��4��װ��G��������__________________��д��G�з�Ӧ�����ӷ���ʽ_____________________��
��5����ͬѧ��Ϊװ��D��E�м��ϸ�������ܻ��ɴֵIJ�������Ϊʲô?___________________________________________________��
���𰸡� ����ʳ��ˮ Ũ���� MnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O A ����ɫ�������װ�� C ����β����ֹ��Ⱦ���� Cl2+2OH-=Cl-+ClO-+H2O �Ȼ�������������ɹ��壬������ϸ��������
������������ʵ��װ��ͼ��֪����ʵ������Ũ������������̷�Ӧ�������������������Ȼ��⡢ˮ�����ʣ����ñ���ʳ��ˮ���Ȼ��⣬����Ũ����������������Ӧ�Ƶ��Ȼ�������Ӧ��β�����������������������գ�Ϊ��ֹ�Ȼ���������������Һ�е�ˮ������Ӧ���������ռ�װ�ú�β������װ��֮���һ����װ��F����1��װ��B��ʢ�ű���ʳ��ˮ��C��F���������ã���װ����ͬһ���Լ������Լ�ΪŨ�����2��װ��A��Բ����ƿ�����ö������̺�Ũ���������ȡ������������Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O����3��ʵ�鲽������ͼ����װ�ú��ȼ���װ������������װҩƷ��Ȼ���ȼA���ƾ��ƣ�������ɫ�������װ��ʱ���ٵ�ȼD���ƾ��ƣ���4��װ��G������������β����ֹ��Ⱦ������ G�з�Ӧ�����ӷ���ʽCl2+2OH-=Cl-+ClO-+H2O����5��װ��D��E�м��ϸ�������ܻ��ɴֵIJ������ܣ������Ȼ�������������ɹ��壬������ϸ�������ܡ�
MnCl2+Cl2��+2H2O����3��ʵ�鲽������ͼ����װ�ú��ȼ���װ������������װҩƷ��Ȼ���ȼA���ƾ��ƣ�������ɫ�������װ��ʱ���ٵ�ȼD���ƾ��ƣ���4��װ��G������������β����ֹ��Ⱦ������ G�з�Ӧ�����ӷ���ʽCl2+2OH-=Cl-+ClO-+H2O����5��װ��D��E�м��ϸ�������ܻ��ɴֵIJ������ܣ������Ȼ�������������ɹ��壬������ϸ�������ܡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֱ�ͨ�뺬�������ӵ���Һ�У�����Ũ�ȱ仯��С���ǣ� ��
A.Fe3+B.HCO3��C.CO32��D.I��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о������õ�Һ��ʯ�����ɷ�Ϊ���飬��ʹ�ù����г���һЩ������Һ̬��ʽ�����ڸ�ƿ�ײ�����Щ���ʿ����ǣ�������
A.����
B.����ͱ���
C.����ͼ���
D.����ͼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3NO2��H2O��2HNO3��NO�У��������뻹ԭ���ķ��Ӹ�����Ϊ
A��2�U1 B��1�U2 C��3�U1 D��1�U3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��������ʵ��ܶȻ�����������
���� | Cu��OH��2 | Fe��OH��3 | CuCl | CuI |
Ksp | 2.2��10��20 | 2.6��10��39 | 1.7��10��7 | 1.3��10��12 |
����ij����CuCl2��Һ�к���������FeCl2 �� Ϊ�õ�������CuCl22H2O���壬����ͼ��������ᴿ��
��1�����ʺ���������X����������ĸ��������X��Ŀ���� �� A��K2Cr2O7 B��NaClO C��H2O2 D��KMnO4
���������Y�����ѧʽ����������ҺpH=4��ʹ��Һ�е�Fe3+ת��ΪFe��OH��3��������ʱ��Һ�е�c��Fe3+��= �� ���˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl22H2O���壮
��2��ijѧϰС���á���ӵ��������ⶨ����CuCl22H2O�������������������I��������Ӧ�����������ʣ��Ĵ��ȣ��������£�ȡ0.36g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000molL��1Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00mL����I2+2S2O32���TS4O62��+2I�����ٿ�ѡ�����ζ�ָʾ������CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ ��
�۸�������CuCl22H2O�������ٷ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��1��105Pa��298K�����£�2mol����ȼ������ˮ�����ų�484kJ�����������Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A.H2O��g��=H2��g��+ ![]() O2��g����H=+242kJmol��1
O2��g����H=+242kJmol��1
B.2H2��g��+O2��g��=2H2O��l����H=��484kJmol��1
C.H2��g��+ ![]() O2��g��=H2O��g����H=+242kJmol��1
O2��g��=H2O��g����H=+242kJmol��1
D.2H2��g��+O2��g��=2H2O��g����H=+484kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ɢϵ�У���ɢ����ֱ�������ǣ� ��
A.�ཬˮB.������������C.�Ȼ�����ҺD.����ͭ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��J��L��M��R��Tԭ��������������Ķ���������Ԫ�أ�J��R�����ڱ��е����λ�������JԪ��������ϼ۵ľ���ֵ����ԭ��������������ȣ�M�ǵؿ��к������Ľ���Ԫ��
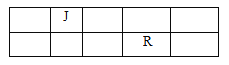
(1)д��RԪ�ص�����26��Ԫ�ص��ʻ��ϵĻ�ѧ����ʽ______________________________��
(2)J������ɵĻ����������6��ԭ�ӣ���ṹ��ʽΪ_______________________________________��
(3)M��T�γɵĻ������ڳ�ʪ�Ŀ�����ð��ɫ��������Ӧ�Ļ�ѧ����ʽΪ_________________��
(4)L�������̬�⻯���ˮ��Һ�Լ��ԡ������ӹ�ҵ�У���ˮ��Һ������ʴ��H2O2�����������������Ӧ�IJ��ﲻ��Ⱦ�������仯ѧ����ʽΪ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��ش��������⣺
��1����֪���¡����������·�����Ӧ��2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)��
N2(g)+2CO2(g)��
������ͼ��˵���÷�Ӧ���е�t1ʱ��δ��ƽ��״̬����________(��ѡ����ĸ)��
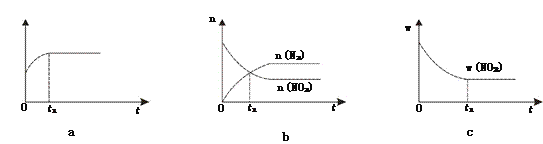
��1 molNO2������C������Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��

ͼ��A��B��C����NO2��ת������ߵ���_____���÷�Ӧ��ƽ�ⳣ��Kp=_______��Kp����ƽ���ѹ����ƽ��Ũ�ȵij�������ѹ����ѹ�����ʵ�����������
(2)��֪��������ʵĵ���ƽ�ⳣ��Ϊ
���� | H2CO | H2S | HNO2 |
����ƽ�ⳣ�� ��25�棩 | Ka1=4.2��10-7 Ka2=5.61��10-11 | Ka1=1.3��10-7 Ka2=7.1��10-15 | Ka=5.1��10-4 |
�ٺ���1L 2mol��L-1̼���Ƶ���Һ�м���1L 1mol��L-1��HNO2������Һ��CO32-��HCO3-��NO2-������Ũ���ɴ�С��_______��
��25��ʱ����0.10 mol��L-1H2S��Һ�У�ͨ��HCl��������NaOH���壬��ҺpH��c(S2-)��ϵ��ͼ��ʾ(������Һ����ı仯��H2S�Ļӷ�)��pH=13ʱ����Һ�е�c(H2S)+c(HS-)=____mol��L-1��
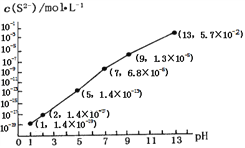
����10.00mL0.10 mol��L-1���������еμ�10.00mL0.1 mol��L-1NaOH��Һ����Һ��_____�ԣ��䶨��������______________________ .
��3����֪����CaSO4��s��+CO��g��![]() CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
CaO��s��+SO2��g��+CO2��g����H = +210.5kJmol-1
��CaSO4��s��+4CO��g��![]() CaS��s��+4CO2��g�� ��H= -189.2kJmol-1
CaS��s��+4CO2��g�� ��H= -189.2kJmol-1
��CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) ��H=_______kJmol-1.
CaS(s)+3CO2(g) ��H=_______kJmol-1.
���𰸡� b A 2MPa c(HCO3- )��c(NO2- )��c(CO32-) 0.043��4.3��10-2 ���� ��ʱǡ������NaHS��Һ��Ka��HS-��=7.1��10-15��Kh��HS-��=KW/ Ka1��H2S��=10-14/(1.3��10-7)=7.7��10-8,��ˮ��̶�Զ���ڵ���̶�,���Գʼ��� -399.7
����������1���ٸ��ݡ����������ƽ�⡱�жϣ�a����Ӧ��̼�ǹ��壬���������µĻ������ܶ��DZ�����t1ʱ���ܶȲ���˵����Ӧ�Ѵ�ƽ��״̬��b��t1ʱ����n(N2)=n(NO2)���Ƿ�Ӧ����������������Һ������ı仯�ɿ�������Ӧ�������û�㶨����û�ﵽƽ��״̬��c��t1ʱ�̶��������������������䣬��Ӧ������ʵ���������ҲӦ���䣬��Ӧ�ﵽƽ��״̬����ѡb����A��B��C�����дﵽƽ��״̬��A��NO2Ũ����С������NO2��ת������ߣ����ɽ�̿��ԭNO2�ķ�ӦΪ��2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)���ں��������£�1 mol NO2������C������Ӧ��C��ʱ��NO2��CO2�����ʵ���Ũ����ȣ���֪��ʱ��Ӧ��ϵ��n(NO2)=0.5mol��n(N2)=0.25mol��n(CO2)=0.5mol�����������ʵķ�ѹ�ֱ�Ϊ��P(NO2)= P(CO2)=10MPa��
N2(g)+2CO2(g)���ں��������£�1 mol NO2������C������Ӧ��C��ʱ��NO2��CO2�����ʵ���Ũ����ȣ���֪��ʱ��Ӧ��ϵ��n(NO2)=0.5mol��n(N2)=0.25mol��n(CO2)=0.5mol�����������ʵķ�ѹ�ֱ�Ϊ��P(NO2)= P(CO2)=10MPa��![]() =4MPa��P(N2)=2MPa��C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=
=4MPa��P(N2)=2MPa��C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)= 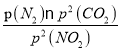 =
=![]() =2MPa����2������������ĵ���ƽ�ⳣ��Ka=5.1��10-4��H2CO��Ka1=4.2��10-7��Ka2=5.61��10-11���ж������������ǿ��̼�ᣬ�������2mol̼���Ƶ���Һ�м���1mol��HNO2������1mol̼�����ơ�1mol�������ƣ����ʣ��1mol̼���ƣ�ˮ��̶ȴ�С˳��ΪCO32-��NO2-��ˮ������HCO3-��������Һ��CO32-��HCO3-��NO2-���ӵ�Ũ�ȴ�С��ϵΪc(HCO3- )��c(NO2- )��c(CO32-)���ڸ��������غ���c(H2S)+c(HS-)+c(S2-)=0.10 mol��L-1������ͼ��֪pH=13ʱ��c(S2-)=5.7��10-2 mol��L-1��c(H2S)+c(HS-)=0.10 mol��L-1-c(S2-)=0.10 mol��L-1-5.7��10-2 mol��L-1= 4.3��10-2 mol��L-1������10.00mL0.10 mol��L-1���������еμ�10.00mL0.1 mol��L-1NaOH��Һ����Һ�ʼ��ԣ��䶨�������Ǵ�ʱǡ������NaHS��Һ��Ka��HS-��=7.1��10-15��Kh��HS-��=KW/ Ka1��H2S��=10-14/(1.3��10-7)=7.7��10-8,��ˮ��̶�Զ���ڵ���̶�,���Գʼ��ԣ���3����֪����CaSO4��s��+CO��g��
=2MPa����2������������ĵ���ƽ�ⳣ��Ka=5.1��10-4��H2CO��Ka1=4.2��10-7��Ka2=5.61��10-11���ж������������ǿ��̼�ᣬ�������2mol̼���Ƶ���Һ�м���1mol��HNO2������1mol̼�����ơ�1mol�������ƣ����ʣ��1mol̼���ƣ�ˮ��̶ȴ�С˳��ΪCO32-��NO2-��ˮ������HCO3-��������Һ��CO32-��HCO3-��NO2-���ӵ�Ũ�ȴ�С��ϵΪc(HCO3- )��c(NO2- )��c(CO32-)���ڸ��������غ���c(H2S)+c(HS-)+c(S2-)=0.10 mol��L-1������ͼ��֪pH=13ʱ��c(S2-)=5.7��10-2 mol��L-1��c(H2S)+c(HS-)=0.10 mol��L-1-c(S2-)=0.10 mol��L-1-5.7��10-2 mol��L-1= 4.3��10-2 mol��L-1������10.00mL0.10 mol��L-1���������еμ�10.00mL0.1 mol��L-1NaOH��Һ����Һ�ʼ��ԣ��䶨�������Ǵ�ʱǡ������NaHS��Һ��Ka��HS-��=7.1��10-15��Kh��HS-��=KW/ Ka1��H2S��=10-14/(1.3��10-7)=7.7��10-8,��ˮ��̶�Զ���ڵ���̶�,���Գʼ��ԣ���3����֪����CaSO4��s��+CO��g��![]() CaO��s��+SO2��g��+CO2��g����H1= +210.5kJmol-1
CaO��s��+SO2��g��+CO2��g����H1= +210.5kJmol-1
��CaSO4��s��+4CO��g��![]() CaS��s��+4CO2��g�� ��H2= -189.2kJmol-1
CaS��s��+4CO2��g�� ��H2= -189.2kJmol-1
���ݸ�˹���ܣ��ɢ�-�ٵ÷�Ӧ��CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) ��H=��H2-��H1= -189.2kJmol-1-210.5kJmol-1=-399.7kJmol-1��
CaS(s)+3CO2(g) ��H=��H2-��H1= -189.2kJmol-1-210.5kJmol-1=-399.7kJmol-1��
�㾦��������Ҫ�ǿ�����������ʵĵ��롢������ʵ�ˮ���Լ���Ӧ�ȼ���ȡ����⿼���֪ʶ��϶࣬���ؿ���ѧ����֪ʶ��Ǩ��Ӧ�ã�ע����Ϣ��������ۺ�Ӧ�á��ѵ��ǵ���ƽ�ⳣ���Լ�����ˮ���Ӧ�á����ʱҪ��ȷ����ƽ�ⳣ���뻯ѧƽ�ⳣ��һ����ƽ�ⳣ��Խ��������ʵĵ���̶�Խ�Ӷ������ж���Ӧ�������ǿ�������������ж���Ӧ���ε�ˮ��̶ȴ�С����2�����еļ���Ҫע�����Ӧ�������غ㣬ͬʱҪע����ͼ����з�������㡣
�����͡�������
��������
9
����Ŀ�����Ȼ�������Ҫ�Ļ���ԭ�ϡ���������ȡ������(B2H6)��Ҳ�����л��ϳɵĴ�����
���������ϡ���BCl3�ķе�Ϊ12.5�棬�۵�Ϊ��107.3�棻
��2B��6HCl![]() BCl3��3H2 ����Ҳ����ǿ�Ӧ��
BCl3��3H2 ����Ҳ����ǿ�Ӧ��
ij�о���ѧϰС����������ʾװ���Ʊ����Ȼ��𡣻ش��������⣺
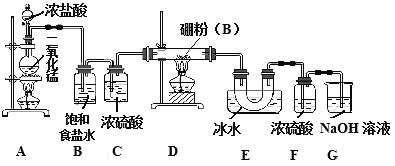
(1)Aװ���з�Ӧ�����ӷ���ʽ_______________________��
(2)Bװ�õ�������____________�������ȥBװ�ã����ܵĺ����__________________��
(3)Dװ���з�����Ӧ�Ļ�ѧ����ʽ_____________��
(4)Gװ�õ�������_____��Ϊʹʵ��װ�ü�㣬����һ��װ�ô���F��Gװ�á���װ������������___����װ�Լ���____��
(5)A��D�������ȵ��Ⱥ�˳����_____________����������_______________��
(6)�����ƵõIJ�Ʒ���Ǻ�����۵�ʵ�������________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com