
【题目】Na2S2O5常用作纺织业棉麻脱氯剂;酸化时可放出SO2气体。其制备工艺流程
如下:
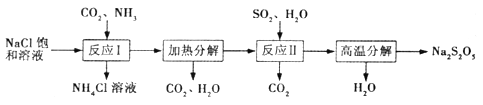
(1)Na2S2O5的名称为_______________(选填“焦硫酸钠”或“焦亚硫酸钠”)。
(2)“反应I ”中应先通入的气体是______,反应后析出的固体产物是____________。
(3)“反应II”的化学方程式为_________________________。
(4)若反应条件或用量等控制不当,则所得的Na2S2O5产品中往往含有杂质。
①若产品中含有杂质Na2SO3,其具体原因可能是______________(任答一条即可);
②若检验产品中含有杂质Na2SO3,下列试剂的使用顺序依次为_________(填编号)。
a.稀硫酸 b.澄淸石灰水 c.品红溶液 d.酸性KMnO4溶液
(5)Na2S2O3也可用作棉麻的脱氯剂。
①Na2S2O5溶液与Cl2反应的离子方程式为____________________;
②Na2S2O5与Na2S2O3脱氯等效时,消耗二者的质量之比为____________。
【答案】 焦亚硫酸钠 NH3(或:氨气) NaHCO3(或:碳酸氢钠) Na2CO3+2SO2+H2O=2NaHSO3+CO2↑ 反应II中SO2的用量不足:NaHSO3分解时反应温度不高 a d c b S2O52-+2Cl2+3H2O==6H++2SO42-+4C1- 190:79(或:2.4:1)
【解析】该原理为:反应Ⅰ为生成NaHCO3,加热生成Na2CO3,在反应Ⅱ中二氧化硫与碳酸钠反应生成NaHSO3与二氧化碳,加热NaHSO3生成Na2S2O5.
(1)S为+4价, Na2S2O5的名称为焦亚硫酸钠;(2)工艺流程可知,反应Ⅰ为生成NaHCO3,氯化钠溶液通入氨气、二氧化碳生成碳酸氢钠与氯化铵,反应方程式为:CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl;反应Ⅰ进行时应先通入氨气,增大HCO3-的浓度,便于NaHCO3析出;(3) “反应II”的化学方程式为Na2CO3+2SO2+H2O=2NaHSO3+CO2↑ (4)反应Ⅱ中发生反应Na2CO3+H2O+2SO2=2NaHSO3+CO2↑,2NaHSO3![]() Na2S2O5+H2O,故SO2与Na2CO3的物质的量之比接近2:1恰好完全反应,若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低,①若产品中含有杂质Na2SO3,其具体原因可能是:反应II中SO2的用量不足:NaHSO3分解时反应温度不高。②产品中可能含有杂质Na2SO3、Na2CO3,a.加稀硫酸产生SO2、CO2,通入d.酸性KMnO4溶液,除去SO2,再通入 c.品红溶液,确定SO2已除尽,最后再通入 b.澄淸石灰水,检验CO2。故试剂的使用顺序依次为a d c b;(5)①Na2S2O5溶液与Cl2反应的离子方程式为 S2O52-+2Cl2+3H2O==6H++2SO42-+4C1- ,S2O32-+4Cl2+5H2O==10H++2SO42-+8C1- ,由方程式可知,当Cl2相同时,2Na2 S2O5~Na2S2O3,消耗二者的质量之比为190×2:158=190:79(或:2.4:1)
Na2S2O5+H2O,故SO2与Na2CO3的物质的量之比接近2:1恰好完全反应,若SO2不足Na2S2O5产品中Na2SO3、Na2CO3等杂质含量增加,Na2S2O5产率降低,①若产品中含有杂质Na2SO3,其具体原因可能是:反应II中SO2的用量不足:NaHSO3分解时反应温度不高。②产品中可能含有杂质Na2SO3、Na2CO3,a.加稀硫酸产生SO2、CO2,通入d.酸性KMnO4溶液,除去SO2,再通入 c.品红溶液,确定SO2已除尽,最后再通入 b.澄淸石灰水,检验CO2。故试剂的使用顺序依次为a d c b;(5)①Na2S2O5溶液与Cl2反应的离子方程式为 S2O52-+2Cl2+3H2O==6H++2SO42-+4C1- ,S2O32-+4Cl2+5H2O==10H++2SO42-+8C1- ,由方程式可知,当Cl2相同时,2Na2 S2O5~Na2S2O3,消耗二者的质量之比为190×2:158=190:79(或:2.4:1)


科目:高中化学 来源: 题型:
【题目】“同位素示踪法,可帮助人们认识化学反应的机理。下列反应中同位素示踪表示正确的是
A. 2Na2O2+2H218O=4NaOH+18O2↑
B. K37ClO3+6HCl=K37Cl+3Cl2↑+3H2O
C. NH4Cl+2H2O![]() NH3·2H2O+HCl
NH3·2H2O+HCl
D. CH3COOH + CH3CH218OH![]() CH3CO18OCH2CH3 + H2O
CH3CO18OCH2CH3 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为分析矿物X中的常见离子,将其溶于稀硝酸,并将所得溶液进行实验,下列依据实验现象得出的结论正确的是
A. 用铂丝蘸取少量溶液进行焰色反应,火焰呈黄色,说明矿物X中不含K+
B. 取少量溶液向其中滴加NaOH溶液,加热,用湿润红色石蕊试纸检验生成的气体,试纸变蓝,说明矿物X中含NH![]()
C. 取少量溶液向其中滴加KSCN溶液,溶液变为红色,说明矿物X中含Fe3+
D. 取少量溶液向其中滴加盐酸酸化的BaCl2溶液,有白色沉淀产生,说明矿物X中含SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量
B.溶液的浓度
C.溶液的密度
D.溶液中Cl-的数目
(3)下列容量瓶的使用方法中,不正确的是______。
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2 cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2 cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(4)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.200 mol·L-1的稀盐酸。
①该学生需要用量筒量取________mL上述浓盐酸进行配制(精确到0.1)。
②在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏大的有________。
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容
B.用量筒量取浓盐酸时俯视观察凹液面
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列所含分子数由多到少的排列顺序是_________________ ,
A.标准状况下33.6LH2
B.所含电子的物质的量为4mol的H2
C.20℃45gH2O
D.常温下,16gO2,与14gN2的混合气体
E.含原子总数约为1.204×1024的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是 。
(2)A、B两种气体组成的混合气体8.6 g,在标准状况下体积为8.96 L。已知A与B的物质的量之比为3∶1,相对分子质量之比为14∶1,由此可推断A可能是 ,B可能是 。
(3)在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是 L,质量是 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮及其化合物是同学们经常能接触到的重要物质,是科学研究的重要对象。
(1)实验室制取乙炔的化学方程式为___________________________。
(2)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图A所示。用CO2和氨气合成尿素的热化学方程式为___________________________。

(3)合理利用CO2、CH4,抑制温室效应成为科学研究的新热点。一种以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸(△H<0)。在不同温度下催化剂的催化效率与乙酸的生成速率分别如上图B所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是________________。250℃和400℃时乙酸的生成速率几乎相等,实际生产中应选择的温度为_________℃。
(4)T℃时,将等物质的量的NO和CO充入体积为2L的 密闭容器中发生反应2NO+2CO![]() 2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。
2CO2+N2。保持温度和体积不变,反应过程中NO的物质的量随时间的变化如图C所示。

①平衡时若保持温度不变,再向容器中充入CO、N2各0.8mol,平衡将______(填“向左”、“向右”或“不”)移动。
②图中a、b分别表示在一定温度下,使用相同质量、不同表面积的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是______(填“a”或“b”)。
③15min时,若改变外界反应条件,导致n(NO)发生如图所示的变化,则改变的条件可能是_____________(任答一条即可)。
(5)垃圾渗滤液中含有大量的氨氮物质(用NH3表示)和氯化物,可用电解原理将溶液中的氨氮物质完全氧化除去。该过程分为两步:第一步:电解产生氯气;第二步:利用氯气将氨氮物质氧化为N2。
①第二步反应的化学方程式为____________________。
②若垃圾渗滤液中氨氮物质的质量分数为0. 034% ,理论上用电解法净化It该污水,
电路中转移的电子数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 含碳元素的化合物一定属有机物
B. 苯的同系物一定属于芳香烃
C. 在石油的分馏实验中,温度计的水银球插入石油中以测液体的温度
D. 石油的分馏、裂化、裂解与煤的干馏均属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年1月,南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子化学式为N5-。下列关于全氮阴离子盐的说法正确的是
A. 每个N5-含有26个电子
B. N5-的摩尔质量为71g·mol-1
C. 全氮阴离子盐既含离子键又含共价键
D. 全氮阴离子盐可能属于电解质,也可能属于非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com