


分析 (1)依据已知热化学方程式构建目标方程式,根据盖斯定律计算得到目标方程式的反应热;
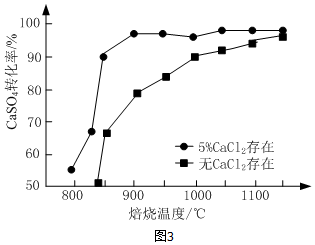
(2)①从图示2可知在低于800℃时主要还原产物为CaS,高于800℃时主要发生硫化钙和硫酸钙反应生成氧化钙和二氧化硫;
②无氯化钙和有氯化钙存在的反应,最终平衡相同,仅改变反应历程,所以CaCl2为催化剂;当温度高于1200℃时,达到平衡,因催化剂不能改变平衡,所以无论有无CaCl2,CaSO4的转化率趋于相同;
③二氧化硫催化氧化生成三氧化硫,三氧化硫与水反应生成硫酸;
(3)碳酸钙更难溶,碳酸铵与硫酸钙反应生成碳酸钙沉淀和磷酸铵.
解答 解:(1)已知①CaSO4•2H2O(s)═CaSO4•$\frac{1}{2}$H2O(s)+$\frac{3}{2}$H2O(g)△H1=83.2kJ•mol-1
②CaSO4•2H2O(s)═CaSO4(s)+2H2O(l)△H2=26kJ•mol-1
③H2O(g)=H2O(l)△H3=-44kJ•mol-1
将②-③×2-①得CaSO4•$\frac{1}{2}$H2O(s)═CaSO4(s)+$\frac{1}{2}$H2O(g),则△H4=[26kJ•mol-1-(-44kJ•mol-1)×2-83.2kJ•mol-1]=30.8kJ•mol-1,
故答案为:30.8;
(2)①从图示2可知,在低于800℃时,CaS成分的物质的量为1,而CaO的物质的量几乎为0,所以在低于800℃时主要还原产物为CaS,高于800℃时主要发生硫化钙和硫酸钙反应CaS+3CaSO4$\frac{\underline{\;高温\;}}{\;}$4CaO+4SO2↑,氧化钙的物质的量增加,硫化钙的物质的量减小,
故答案为:CaS;CaS+3CaSO4$\frac{\underline{\;高温\;}}{\;}$4CaO+4SO2↑;
②催化剂仅能改变反应的速率,改变反应历程,但不能改变化学平衡,从图示可知,当温度高于1200℃时,无论有无CaCl2,CaSO4的转化率趋于相同,所以CaCl2的作用是作催化剂,当温度高于1200℃时,无论有无CaCl2,CaSO4的反应两种情况下反应均达到平衡,催化剂CaCl2不改变平衡的移动,
故答案为:作催化剂;催化剂CaCl2不改变平衡的限度;
③SO2与水反应生成SO2,反应的化学方程式为:2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;三氧化硫与水反应生成硫酸,反应方程式为:SO3+H2O=H2SO4,
故答案为:2SO2+O2$\frac{\underline{\;催化剂\;}}{△}$2SO3;SO3+H2O=H2SO4;
(3)将CaSO4投入(NH4)2CO3溶液中,实现了沉淀的转化,反应的离子方程式为:CaSO4+CO32-=CaCO3↓+SO42-,
故答案为:CaSO4+CO32-=CaCO3↓+SO42-.
点评 本题考查较为综合,涉及物质制备、反应热与焓变的应用、化学平衡的影响等知识,明确实验目的为解答关键,注意掌握盖斯定律的内容、化学平衡及其影响,试题培养了学生的分析、理解能力及综合应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验室中将钠保存于煤油或石蜡油中 | |
| B. | 金属镁着火使用泡沫灭火器灭火 | |
| C. | 用湿润的淀粉-KI试纸鉴别NO2和溴蒸气 | |
| D. | 配制一定物质的量浓度的溶液时,向容量瓶中倒入液体至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0的反应,升高温度v正增大,v逆减小,平衡向正反应方向移动 | |
| B. | 若化学平衡移动了,但正、逆反应不一定都变化 | |
| C. | 正、逆反应速率都变化了,化学平衡必发生移动 | |
| D. | 石墨吸收能量后可转化为金刚石,说明金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | |
| B. | 原子序数:B>A>C>D | |
| C. | 最高价氧化物对应水化物的碱性:B>A | |
| D. | 四种元素一定都属于短周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$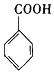
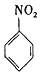 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧化)
(苯胺,易被氧化) .
. .
. .
. 最合理的方案(不超过3步).
最合理的方案(不超过3步). $→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
$→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $\stackrel{铑催化剂}{→}$
$\stackrel{铑催化剂}{→}$ (R1代表氢原子或烃基)
(R1代表氢原子或烃基)
 +
+ $\stackrel{碱}{→}$
$\stackrel{碱}{→}$ +H2O
+H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色. |
| ② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-O | O=O | N≡N | N-H |
| 键能KJ•mol-1 | 463 | 496 | 942 | 391 |
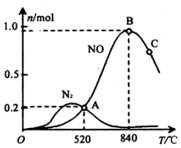
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X、Z、W各自最高和最低化合价的代数和分别为1、4、6 | |
| B. | 原子半径的大小为Y>Z>W | |
| C. | 元素的非金属性顺序为W>Z>X | |
| D. | Y和其他3种元素均能形成离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com