
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
分析 (1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金;
(2)可以用磁铁检验产物中是否含有铁;
(3)金属铝能和氢氧化钠反应放出氢气,而金属铁和氢氧化钠不反应,据此设计实验方案检验合金中的铝.
解答 解:(1)铝的熔点比铁低,生成铁和液态铝一起滴落至盛有沙子的容器中形成合金,所以铝热反应所得到的熔融物应是铁铝合金,
故答案为:合理;
(2)验证产物中有Fe,最简单的方法为:用磁铁,若能吸引则可验证产物中有Fe,
故答案为:用磁铁,若能吸引则可验证产物中有Fe;
(3)金属铝能和氢氧化钠反应放出氢气:2Al+2OH-+2H2O=2AlO2-+3H2↑,而金属铁和氢氧化钠不反应,可以用氢氧化钠溶液证明上述所得的块状熔融物中含有金属铝,所以选用的试剂为氢氧化钠溶液,操作方法及现象为:取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝,
故答案为:
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许熔融物,滴加氢氧化钠溶液,振荡,有气泡产生,证明熔融物中有金属铝 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
点评 本题考查铝热反应原理、金属铝的化学性质,题目难度中等,注意掌握铝热反应原理,明确铝的化学性质及合金的性质,试题有利于培养学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若化合物M其原子个数比为14:4:5:1:1,则其化学式为[Cu(NH3)4]SO4•H2O | |
| B. | 若该化合物为配合物,则E离子给出孤对电子 | |
| C. | C元素与D元素形成的一种具有较强还原性的分子的VSEPR模型为平面三角形 | |
| D. | DC42-空间构型为正四面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
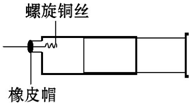 某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.
某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO.实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol铁在氯气中完全反应失去的电子数为0.2NA | |
| B. | 常温常压下,1L 0.1mol•L-1氯化铝溶液中含有0.3 NA个Cl- | |
| C. | 标准状况下,22.4L氨水中含有NA个NH3分子 | |
| D. | 常温常压下,24g镁条投入足量稀硫酸中生成22.4L H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学用如图所示装置制取氯水并进行相关实验.
某同学用如图所示装置制取氯水并进行相关实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂或方法 | |
| A | 碘水 | Br2 | 乙醇、萃取 |
| B | FeCl3溶液 | CuCl2 | Fe |
| C | Fe2O3 | Al2O3 | 盐酸 |
| D | NaHCO3溶液 | Na2CO3 | 通入过量的CO2 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com