

| A. | 电解过程中,a电极表面先有红色物质析出,后有气泡产生 | |
| B. | b电极上发生的反应方程式为:2H2O+2e-═2OH-+H2↑ | |
| C. | 从P到Q点时收集到的混合气体的平均摩尔质量为12 g/mol | |
| D. | 从开始到P点收集到的气体是O2 |
分析 由图可知,电流由正极流向负极,则b为阳极,a为阴极,惰性电极电解一定量的硫酸铜溶液,发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,结合图2可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,P到Q点时收集到的混合气体为氢气和氧气,以此来解答.
解答 解:由图可知,电流由正极流向负极,则b为阳极,a为阴极,惰性电极电解一定量的硫酸铜溶液,发生2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,结合图2可知,通过0.2mol电子时电解硫酸铜,然后电解硫酸溶液,发生2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,
A.a为阴极,先发生Cu2++2e-═Cu,后发生2H++2e-═H2↑,a电极表面先有红色物质析出,后有气泡产生,故A正确;
B.b为阳极,溶液中的氢氧根离子放电,则b电极上发生的反应方程式为:4OH--4e-═H2O+O2↑,故B错误;
C.PQ段3.36L气体中,由电解水反应可知0.2mol电子通过时生成0.1mol H2、0.05mol O2,故混合气体的平均摩尔质量为$\frac{0.05×32+0.1×2}{0.1+0.05}$=12g•mol-1,故C正确;
D.由上述分析可知,曲线0~P段表示O2的体积变化,曲线P~Q段表示H2和O2混合气体的体积变化,故D正确.
故选:B.
点评 本题考查电解原理,明确图象这电子转移与生成气体的关系及离子的放电顺序是解答本题的关键,熟悉电解原理即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
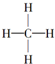 |  | 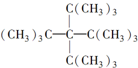 | … |
| 1 | 2 | 3 | … |
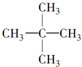
| A. | C36H74 | B. | C36H72 | C. | C53H106 | D. | C53H108 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、汤姆生、卢瑟福、玻尔 | |
| B. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则受PM2.5污染的大气不一定能产生丁达尔现象 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| D. | 并不是所有金属元素都可以用焰色反应来确定其存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 | |
| B. | Na2O2中阳离子与阴离子的个数比为1:1 | |
| C. | Ba(OH)2•8H2O晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应 | |
| D. | 由H2→2H的过程需要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .其中心原子的杂化类型为sp3.
.其中心原子的杂化类型为sp3. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{N}{V}$ mol•L-1 | B. | $\frac{2N}{3V}$ mol•L-1 | C. | $\frac{N}{2V}$ mol•L-1 | D. | $\frac{3N}{2V}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
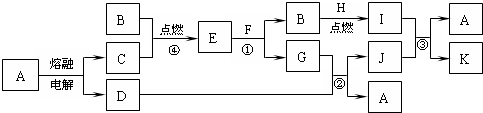
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有Cl-存在 | |
| B. | 加入几滴KSCN溶液,溶液变成红色,可确定有Fe3+存在 | |
| C. | 加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在 | |
| D. | 加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com