
【题目】I.现有三个反应:
反应①![]()
![]() =a kJ/mol平衡常数为K1
=a kJ/mol平衡常数为K1
反应②![]()
![]() 平衡常数为K2
平衡常数为K2
反应③![]()
![]() =b kJ/mol平衡常数为K3
=b kJ/mol平衡常数为K3
在不同温度下,部分K1、K2的值如下:
T/℃ | 700 | 800 |
K1 | 2.38 | 2.56 |
K2 | 0.80 |
(1) ![]()
![]() ==____________________
==____________________
(2)K1的表达式为____________;根据反应①、②、③推导出K1、K2、K3的关系式K3=______________。
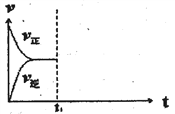
(3)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应②,当反应达到平衡后,维持温度与压强不变,t1时再通入各1mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图_______。
Ⅱ.在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g):
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOx转化率,绘得图像如下图所示:
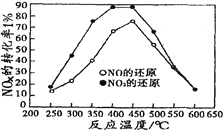
①从图中可以得出的结论是
结论一:从测定NOx转化数据中判断,相同温度下NO转化效率比NO2的低。
结论二:________________________________________________________
②在上述NO2和C3H6反应中,提高NO2转化率的措施有_____________。(填编号)
A.加入催化剂 B.降低温度 C.分离出H
Ⅲ.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10 -5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+ H+ 的平衡常数K1=___________。(已知:10-5.60=2.5×10-6 )
【答案】 (a-b) kJ/mol ![]()
![]()
 在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小(或450℃,NOx与C3H6的反应达到平衡,且正反应是放热反应) BC 4.2×10-7 mol/L
在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小(或450℃,NOx与C3H6的反应达到平衡,且正反应是放热反应) BC 4.2×10-7 mol/L
【解析】 (1) 反应①![]()
![]() =a kJ/mol,反应③
=a kJ/mol,反应③![]()
![]() =b kJ/mol,根据盖斯定律,将①-③得:
=b kJ/mol,根据盖斯定律,将①-③得: ![]()
![]() =(a-b) kJ/mol,故答案为:(a-b) kJ/mol;
=(a-b) kJ/mol,故答案为:(a-b) kJ/mol;
(2)K1的表达式为![]() ;将方程式①-②得方程式③,则K3=
;将方程式①-②得方程式③,则K3=![]() ;故答案为:
;故答案为: ![]() ;
; ![]() ;
;
(3)由于该反应是前后体积不变的反应,在恒压条件下,再通入各1mol的CO和H2O的混合气体,与起始量之比相同,平衡后与原平衡为等效平衡,在增加反应物的开始,容器体积增大,反应物浓度增大,生成物浓度变小,所以正反应速率变大,逆反速率减小,但最终平衡不移动,据此画出图为 ,故答案为:
,故答案为: ;
;
Ⅱ.①通过图像知,NO转化效率比NO2的低;在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小,故答案为:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小;
②根据图像知,温度越高(450℃),二氧化氮的转化率越小,所以该反应是放热反应,且该反应是气体体积增大的反应。A、催化剂只改变反应到达平衡的时间,不改变化学平衡状态,故A错误;B、该反应是放热反应,所以降低温度,平衡向正反应方向移动,增大二氧化氮的转化率,故B正确;C、分离出H2O(g),减少生成物的浓度,平衡向正反应方向移动,增大二氧化氮的转化率,故C正确;D、该反应是气体体积增大的反应,增大压强,平衡向逆反应方向移动,二氧化氮的转化率降低,故D错误;故答案为:BC;
Ⅲ.饱和CO2水溶液的pH=5.60,所以c(H+)=10-5.6=2.5×10-6mol/L,c(H2CO3)=1.5×10-5molL-1,H2CO3的第一级电离方程式为:H2CO3HCO3-+H+,H2CO3的第一级电离的平衡常数K1=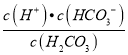 =
=![]() =4.2×10-7 mol/L,故答案为:4.2×10-7 mol/L。
=4.2×10-7 mol/L,故答案为:4.2×10-7 mol/L。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下列有关第VIIA族元素说法不正确的是( )
A.原子最外层电子数都是7
B.从上到下原子半径逐渐增大
C.单质从F2到I2,颜色逐渐加深
D.单质从F2到I2,氧化性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物由C、H、O三种元素组成,球棍模型如图所示:

①含有的官能团名称是_______;
②写出此有机物与金属钠反应的化学方程式_______。
(2)四种常见有机物分子的比例模型示意图如下,其中甲、乙、丙为烃,丁为烃的衍生物。

①可以鉴别甲和乙的试剂为_________;
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
②上述物质中有毒、有特殊气味,且不溶于水、密度比水小的是_________(填名称),将其加入溴水中,振荡后静置,观察到的现象是_______。
③乙和丁的物质的量共1.5mol,完全燃烧需要的氧气的物质的量是_______。
(3)乳酸(![]() )是一种有机物,它在多种生物化学过程中起重要作用。
)是一种有机物,它在多种生物化学过程中起重要作用。
①1mol乳酸与足量的Na反应生成氢气的物质的量是_______。
②乳酸与铁粉反应生成乳酸亚铁,可用于治疗缺铁性贫血。反应的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HX溶液、HY溶液、HY和NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是

A. HX、HY均为一元强酸
B. 溶液中水的电离程度:a = b < c
C. 常温下,HY的电离常数Ka约为1.0×10-4
D. c点溶液:c(Na+)>c(Y-)>c(HY) >c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生如下反应:3A(g)![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1阶段的c(B)变化未画出]。下列说法中正确的是
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1阶段的c(B)变化未画出]。下列说法中正确的是

A. 若t1=15s,则用A的浓度变化表示t0~t1阶段的平均反应速率为0.004 mol/(L·s)
B. t1时该反应达到平衡,A的转化率为40%
C. 该容器的容积为2L,B的起始的物质的量为0.02 mol
D. t0~t1阶段,此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式为3A(g)![]() B(g)+2C(g) △H=-50a/3 kJ/mol
B(g)+2C(g) △H=-50a/3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以对甲苯酚A为起始原料,通过一系列反应合成有机物G和F。

已知:

 (羟醛缩合反应)
(羟醛缩合反应)
(1)D中含氧的官能团______________ ⑥反应类型_______________。
(2)若C和甲乙酮(![]() )在上述条件下,发生类似Ⅱ的反应产生互为同分异构体的两种有机物,写出它们的结构简式______________________________、_______________________________。
)在上述条件下,发生类似Ⅱ的反应产生互为同分异构体的两种有机物,写出它们的结构简式______________________________、_______________________________。
(3)写出反应②的化学方程式____________________________________________________________。
(4)在反应⑤之前增加步骤④的目的是___________________________。
(5)符合下列条件的F同分异构体有__________种
①发生银镜反应 ②与FeCl3溶液发生显色反应 ③苯环上一氯代物有两种
(6)参照上述合成路线和相关信息,设计以乙醛为原料(无机试剂任选)制备高级吸水性树脂 的合成路线_____________。
的合成路线_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组欲测定市场上某H2O2消毒液质量分数,现进行如下操作
己知:2MnO4﹣+5H2O2+6H+═2Mn2++8H2O+5O2
操作①:取10.00mLH2O2溶液(密度为1.00gmL﹣1)置于锥形瓶中加水稀释,再加稀硫酸酸化;
操作②:用0.200 0molL﹣1KMnO4溶液滴定;
操作③:用同样方法滴定,4次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL、22.00mL.请回答下列问题:
(1)滴定时盛装KMnO4溶液应选取的仪器是(填序号).
A.50mL酸式滴定管
B.50mL碱式滴定管
C.25mL酸式滴定管
D.25mL碱式滴定管
(2)是否需要选用指示剂(填“是”或“否”)达到滴定终点的现象是 .
(3)分析数据,计算该H2O2溶液中溶质的质量分数为(保留三位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2CO3和H2SO3的电离常数如下表:
酸 | Ka1 | Ka2 |
H2CO3 | 4.27×10-7 | 5.61×10-11 |
H2SO3 | 1.54×10-2 | 1.02×10-7 |
向10mL0.1mol/LNa2CO3溶液中滴加0.1mol/LH2SO3溶液,测得溶液pH随加入H2SO3溶液体积的变化如图所示。
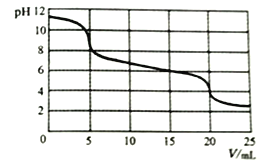
下列说法不正确的是
A. 加入H2SO3溶液前,Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
B. 0<V<5时,溶液中反应为:H2SO3+CO32-==HCO3-+HSO3-
C. 15<V<20时,溶液中反应为:H2SO3+HCO3-==HSO3-+CO2↑+H2O
D. V=15时,所得溶液中:(HCO3-)<c(HSO3-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com