
| A、一定含甲烷,不含乙烷 |
| B、一定含乙烷,不含甲烷 |
| C、可能是甲烷和乙烯的混合物 |
| D、一定含甲烷,但不含乙烯 |


科目:高中化学 来源: 题型:
 A、B、C三种物质的转化关系如图所示(部分产物已略去).A是常见的金属单质,通常状况下Y单质是气体,A在Y中燃烧生成棕褐色烟,反应①、②均在水溶液中进行.请回答:
A、B、C三种物质的转化关系如图所示(部分产物已略去).A是常见的金属单质,通常状况下Y单质是气体,A在Y中燃烧生成棕褐色烟,反应①、②均在水溶液中进行.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
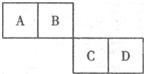 已知A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,它们的原子序数之和为46.请填空:
已知A、B、C、D四种短周期元素在元素周期表中的相对位置如图所示,它们的原子序数之和为46.请填空:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2 H2O |
| B、向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ |
| C、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6 Cl- |
| D、醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
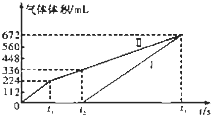 常温下用惰性电极电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(以下气体体积已换算成标准状况下的体积).根据图中信息回答下列问题.
常温下用惰性电极电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(以下气体体积已换算成标准状况下的体积).根据图中信息回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:13 | B、13:2 |
| C、7:1 | D、1:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解过程中在阴极产生氯气 |
| B、该过程是化学能转化为电能 |
| C、在阳极有Cu生成 |
| D、生成的氯气可以用湿润的淀粉碘化钾试纸检测出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com