
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为NA
B.3.6 g重水中含有的中子数为2NA
C.一定条件下,6.4 g铜与过量的硫反应,转移电子数目为0.2NA
D.常温下,1 L 1 mol·L-1的CH3COOH溶液中,所含溶质分子数小于NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
230Th和232Th是钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
|
| A. | Th元素的质量数是232 | B. | Th元素的相对原子质量是231 |
|
| C. | 232Th转化成233U是化学变化 | D. | 230Th和232Th的化学性质相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
|
| A. | 1L 1mol•L﹣1的NaClO 溶液中含有ClO﹣的数目为NA |
|
| B. | 标准状况下,一定量的铜与硝酸反应后生成22.4 L NO、NO2、N2O4的混合气体,则被还原的硝酸的分子数大于NA |
|
| C. | 铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标况下) |
|
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是
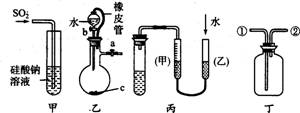
A.甲装置:可用来证明硫的非金属性比硅强
B.乙装置:橡皮管的作用是能使水顺利流下
C.丙装置:用图示的方法能检查此装置的气密性
D.丁装置:可在瓶中先装入某种液体收集NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A.NO2由反应N2+2O2 2NO2生成
2NO2生成
B.总反应可表示为2SO2+O2+2H2O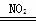 2H2SO4
2H2SO4
C.还可能发生的反应有4NO2+O2+2H2O=4HNO3
D.还可能发生的反应有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g) cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
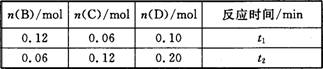
下列说法正确的是
A.0~t1时间段内,平均反应速率v(B)=0.04/t1 mol·(L·min)-1
B.若起始时n(D)=0,则t2时v(D)=0.20/t2 mol·(L·min)-1
C.升高温度,v(B)、vC)、v(D)均增大
D.b:d=6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜(含有少量的锌、铁、银、金等金属和少量矿物杂质)的提纯,并对阳极泥和电解液中金属进行回收和含量测定。请回答以下问题。
(1)电解时,粗铜应与电源的 极相连,阴极上的电极反应式为 ;电解过程中,硫酸铜的浓度会 (选填“变大”“不变”或“变小”)。
(2)电解完成后,该小组同学将电解液过滤后对滤液和阳极泥分别进行处理:
①阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
②Cu的回收、滤液成分及含量的测定:以下是该小组设计的一个实验流程。
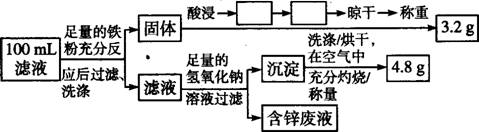
在上述流程中空格内填上相应的操作: 、 ;100 mL滤液中Cu2+的浓度为 mol/l,Fe2+的浓度为 mol/l。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g)  Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
A.60 s内X的平均反应速率为0.001 mol·L-1·s-1
B.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2
C.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大
D.若升高温度,X的体积分数增大,则正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是一款笔记本电脑所用甲醇燃料电池的结构示意图。
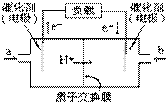
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:
2CH3OH+3O2 = 2CO2+4H2O 下列说法正确的是( )
A.右电极为电池的正极,b处通入的物质是空气
B.左电极为电池的负极,a处通入的物质是空气
C.正极反应式为:CH3OH+H2O-6e- = CO2+6H+
D.正极反应式为:O2+2H2O+4e-=4OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com