
【题目】下列说法正确的是( )
A.电解精炼铜时,阳极泥中含有![]() 等金属
等金属
B.![]() 通入足量水中,转移电子的数目为
通入足量水中,转移电子的数目为![]()
C.反应![]() 在常温下不能自发进行,说明该反应的
在常温下不能自发进行,说明该反应的![]()
D.等质量的硫蒸气和硫粉分别在空气中完全燃烧,前者放出热量多
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)又称海波,呈无色透明状,易溶于水,不溶于乙醇,常用作棉织物漂白后的脱氯剂、定量分析中的还原剂。
Ⅰ. Na2S2O3·5H2O的制备
Na2S2O3·5H2O的制备方法有多种,其中亚硫酸钠法是工业和实验室中的主要方法:Na2SO3 + S + 5H2O ![]() Na2S2O3·5H2O
Na2S2O3·5H2O
制备过程如下:
①称取12.6g Na2SO3于100mL烧杯中,加50 mL去离子水搅拌溶解。
②另取4.0 g硫粉于200mL烧杯中,加6 mL乙醇充分搅拌均匀将其润湿,再加入Na2SO3溶液,隔石棉小火加热煮沸,不断搅拌至硫粉几乎全部反应。
③停止加热,待溶液稍冷却后加2 g活性炭,加热煮沸2分钟(脱色)。
④趁热过滤,得滤液至蒸发皿中, ______________、____________________。
⑤过滤、洗涤,用滤纸吸干后,称重,计算产率。
(1)加入的硫粉用乙醇润湿的目的是____________________________。
(2)步骤④趁热过滤的原因_____________________,空格处应采取的操作是_________________、____________________。
(3)步骤⑤洗涤过程中,为防止有部分产品损失,应选用的试剂为___________。
(4)滤液中除Na2S2O3和未反应完全的Na2SO3外,最可能存在的无机杂质是________________,生成该杂质的原因可能是____________________________。
Ⅱ.产品纯度的测定
准确称取1.00 g产品(硫代硫酸钠晶体的摩尔质量为248 g/mol),用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol/L碘标准溶液滴定至终点,消耗21.00 mL。反应的离子方程式为:2S2O32-+I2=S4O62-+2I-。
(5)计算所得产品的纯度为___________(保留三位有效数字),该数据的合理解释可能是__________(不考虑实验操作引起的误差)。
Ⅲ.产品的应用
(6)Na2S2O3常用于脱氯剂,在溶液中易被Cl2氧化为SO42-,该反应的离子方程式为 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,可逆反应mA(g) + nB(g)![]() pC(g)的化学平衡常数为K,下列说法正确的是
pC(g)的化学平衡常数为K,下列说法正确的是
A. 其他条件不变,升高温度,K 值一定增大
B. 其他条件不变,增大B(g)的浓度,K值增大
C. 其他条件不变,增大压强,K值不变
D. K值不会随反应条件的改变而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为燃料,在化石能源和可再生能源时期均有广泛的应用前景。
I. 甲醇可以替代汽油和柴油作为内燃机燃料。
(1)汽油的主要成分之一是辛烷[C8H18(l)]。已知:25℃、101 kPa时,1 mol C8H18(l)完全燃烧生成气态二氧化碳和液态水,放出5518 kJ热量。该反应的热化学方程式为______。
(2)已知:25℃、101 kPa时,CH3OH(l) + 3/2 O2(g) ==== CO2 (g) + 2H2O(l) Δ H=-726.5 kJ/mol。相同质量的甲醇和辛烷分别完全燃烧时,放出热量较多的是______。
(3)某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如右所示。
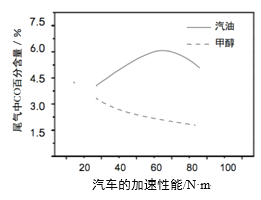
根据图信息分析,与汽油相比,甲醇作为燃料的优点是______。
II. 甲醇的合成
(4)以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。

① 补全上图:图中A处应填入______。
② 该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的ΔH______(填“变大”“变小”或“不变”)。
(5)已知: CO(g)+1/2 O2(g) ==== CO2(g) ΔH1=-283 kJ/mol
H2(g)+1/2 O2(g) ==== H2O(g) ΔH2=-242 kJ/mol
CH3OH(g) + 3/2 O2(g) ==== CO2 (g) + 2H2O(g) ΔH3=-676 kJ/mol
以CO(g)和H2(g)为原料合成甲醇的反应为CO(g) + 2H2(g) ==== CH3OH(g) 。该反应的ΔH为_____ kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() ,发生反应
,发生反应![]() 。反应过程中
。反应过程中![]() 随时间变化的曲线如图所示,下列说法不正确的是( )
随时间变化的曲线如图所示,下列说法不正确的是( )
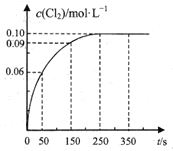
A.反应在![]() 的平均速率
的平均速率![]()
B.该温度下,反应的平衡常数值![]()
C.保持其他条件不变,升高温度,若平衡时![]() ,则该反应的
,则该反应的![]()
D.反应达平衡后,再向容器中充入![]() ,该温度下再达到平衡时,
,该温度下再达到平衡时,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)H2(g)+I2(g),若 15 s 内 c(HI)由 0.1 mol·L-1 降到 0.07 mol·L-1,则下列说法正确的是
A.0~15 s 内用 I2 表示的平均反应速率为 v(I2)=0.015 mol·L-1·s-1
B.c(HI)由 0.07 mol ·L-1 降到 0.05 mol·L-1 所需的反应时间小于 10 s
C.升高温度,正反应速率加快,逆反应速率减慢
D.减小容器的体积,反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是盛放液溴的试剂瓶剖面图,仔细观察分成了明显的气相、溴溶液相和液溴相三相,下列说法错误的是( )

A.气相呈现红棕色,因为其中含有Br2的蒸汽
B.溴溶液相中显酸性,主要因为HBr电离出了H![]()
C.液溴保存时加水形成水封的目的是减少Br2的挥发
D.液溴保存时不可敞口放置,应保存在细口瓶中并塞上橡胶塞
查看答案和解析>>
科目:高中化学 来源: 题型:
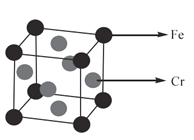
【题目】不锈钢(Stainless Steel)是不锈耐酸钢的简称,耐空气、蒸汽、水等腐蚀。不锈钢中含有Fe、Cr等元素。回答下列问题:
(1)铬(Cr)的价电子排布图为______
(2)亚铁氰化钾别名黄血盐,化学式:![]() ,加入食盐中可防止食盐板结。其中C、N、O三元素的第一电离能由小到大顺序为______。O和N的简单氢化物沸点明显高于CH4原因是______,其不含结晶水的盐结构如图所示,其中C原子的杂化方式为______。
,加入食盐中可防止食盐板结。其中C、N、O三元素的第一电离能由小到大顺序为______。O和N的简单氢化物沸点明显高于CH4原因是______,其不含结晶水的盐结构如图所示,其中C原子的杂化方式为______。

(3)1mol的![]() 中含有的共价键物质的量为______mol,该配位化合物的配位原子为______。
中含有的共价键物质的量为______mol,该配位化合物的配位原子为______。
(4)用______实验可以直接确定某固体是否是晶体,某种铁铬合金的晶胞如图所示,该晶体堆积模型为______,空间利用率是______;若已知该晶胞的棱长为a pm,则该晶胞的密度为______g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得

下列说法中正确的是( )
A.1mol雷琐苯乙酮最多能与3mol氢气发生加成反应
B.两分子苹果酸的一种缩合产物是:![]()
C.1mol产物伞形酮与溴水反应,最多可消耗3mol Br2,均发生取代反应
D.反应中涉及到的三种有机物都能跟FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com