
制备Fe(OH)3胶体,下列操作方法能使之成功的是( )
A.把Fe2O3粉末放在水中加热至沸
B.氯化铁溶液中加少量氨水
C.把约30 mL蒸馏水加热至沸,滴入几滴浓氯化铁溶液
D.在约30 mL蒸馏水中加数滴氯化铁浓溶液
科目:高中化学 来源: 题型:
一定条件下反应mA(g)+nB(g)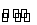 pC(g)+qD(g)在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是( )
pC(g)+qD(g)在一密闭容器中进行,测得平均反应速率v(C)=2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是( )
A.2、6、3、5 B.3、1、2、1
C. 3、1、2、2 D.1、3、2、2
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5。
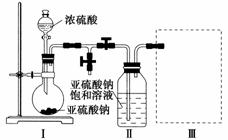
(1)装置Ⅰ中产生气体的化学方程式为________________________。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是________________________。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
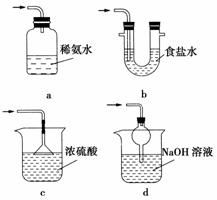
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO 的电离程度大于水解程度,可采用的实验方法是 ________ (填序号)。
的电离程度大于水解程度,可采用的实验方法是 ________ (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是________________________。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
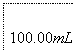

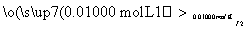 溶液出现蓝色且30 s内不褪色
溶液出现蓝色且30 s内不褪色
(已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有BaCl2稀溶液的甲、乙两试管中分别通入SO2至饱和,若向甲试管中加入足量的硝酸,乙试管中通入足量的氨气,则对两试管中的现象描述正确的是( )
A.甲乙两试管都有白色沉淀生成
B.甲乙两试管都没有白色沉淀生成
C.甲试管没有白色沉淀而乙试管有
D.甲试管有白色沉淀而乙试管没有
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:

请回答有关问题:
(1)甲方案:
①写出该反应的离子方程式______________;
②为了节约原料,硫酸和硝酸的物质的量之比最佳为n(H2SO4)∶n(HNO3)=__________。
(2)乙方案:将6.4 g铜丝放到90 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入40 mL 10%的H2O2,反应0.5 h,升温到60 ℃,持续反应1 h后,经一系列操作,得CuSO4·5H2O 20.0 g[已知有关摩尔质量:M(Cu)=64 g·mol-1,M(CuSO4·5H2O) =250 g·mol-1]。
①反应时温度控制在50~60 ℃,不宜过高的原因是______________;
②本实验CuSO4·5H2O的产率为______________。
(3)丙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4,然后过滤、浓缩、结晶。
①物质A可选用以下的________(填序号);
A.CaO B.NaOH C.CuCO3
D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是______________;
(4)对比甲、乙、丙三种实验方案,丙方案的优点有(写两条):____________________、__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:酸式乙二酸钠与浓硫酸共热时反应为
HOOC—COONa+H2SO4(浓)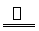 NaHSO4+CO2↑+CO↑+H2O。
NaHSO4+CO2↑+CO↑+H2O。
利用该反应所产生的气体(X)及下列有关仪器装置进行以下实验:
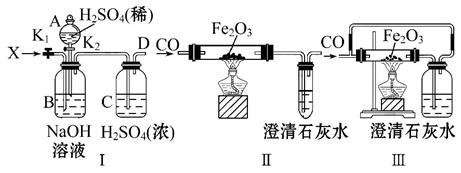
下列说法不正确的是( )
A.对装置Ⅰ,关闭活塞K2,打开活塞K1,在导管D处能得到纯净而干燥的CO
B.当A选项反应完成后,再关闭活塞K1,打开活塞K2,在导管D处能得到纯净而干燥的CO2
C.利用装置Ⅰ中D处所得的纯净CO,通过实验装置Ⅱ能够说明CO具有还原性
D.实验装置Ⅲ与实验装置Ⅱ相比较,能减少CO的污染,能顺利完成氧化铁还原实验
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一个2L的密闭容器中,加入 4molA和2molB进行如下反应:3A(g)+2B(g)
4molA和2molB进行如下反应:3A(g)+2B(g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是
A.该反应的化学平衡常数表达式是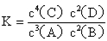
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为了验证海带中含有碘元素,拟进行如下实验,请完成相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中不会用到的实验仪器有 (填代号)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是 。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用 (填代号)。
A.浓硫酸 B.新制氯水
C.KMnO4溶液 D.H2O2
理由是 。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含有碘元素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com