
����Ŀ���Ը�����[��Ҫ�ɷ�Ϊ![]() ��������
��������![]() ������]Ϊԭ������
������]Ϊԭ������![]() ��һ�ֹ����������£�
��һ�ֹ����������£�
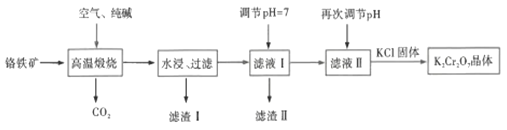
�ش��������⣺
��1��![]() �������������ʽ��ʾΪ___________��
�������������ʽ��ʾΪ___________��
��2����������ʱ![]() �ֱ��봿�Ӧ���������ֱ�Ϊ
�ֱ��봿�Ӧ���������ֱ�Ϊ![]() ��___________��
��___________��![]() ������Ӧ�Ĺ��������Ϊ
������Ӧ�Ĺ��������Ϊ![]() ��һ�ֺ���ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ______________________�����������У�������������ʵ�����н��У�����ѡ�õ�����Ϊ___________�����ţ���
��һ�ֺ���ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽΪ______________________�����������У�������������ʵ�����н��У�����ѡ�õ�����Ϊ___________�����ţ���
a.�ձ� b.������ c.������ d.������
��3������I����Ҫ�ɷ���___________������pH=7��Ŀ����___________��
��4���ٴε���pH������Һ���м���![]() ʹpH��С����Һ�ɻ�ɫ��Ϊ��ɫ��������Ӧ�����ӷ���ʽΪ______________________���ܷ����������
ʹpH��С����Һ�ɻ�ɫ��Ϊ��ɫ��������Ӧ�����ӷ���ʽΪ______________________���ܷ����������![]() ����pH___________����ܡ�����
����pH___________����ܡ�����
��5�����ɫ��Һ�м���![]() ���壬���
���壬���![]() ����IJ��������Ǽ���Ũ����___________�����ˡ�ϴ�ӡ����
����IJ��������Ǽ���Ũ����___________�����ˡ�ϴ�ӡ����
���𰸡�FeO��Cr2O3 Na2SiO3 4Fe(CrO2)2+7O2+8Na2CO3 ![]() 2Fe2O3 +8Na2CrO4+8CO2 d Fe2O3 ʹAlO2-��SiO32-�γ�Al(OH)3��H2SiO3������ȥ 2CrO42- +2H+
2Fe2O3 +8Na2CrO4+8CO2 d Fe2O3 ʹAlO2-��SiO32-�γ�Al(OH)3��H2SiO3������ȥ 2CrO42- +2H+![]() Cr2O72-+H2O �� ��ȴ�ᾧ
Cr2O72-+H2O �� ��ȴ�ᾧ
��������
��1��![]() ��FeΪ+2�ۡ�CrΪ+3�ۣ�
��FeΪ+2�ۡ�CrΪ+3�ۣ�
��2����������ʱ SiO2�봿�Ӧ���ɹ����ƺͶ�����̼��![]() �봿�Ӧ�Ĺ��������Ϊ
�봿�Ӧ�Ĺ��������Ϊ![]() ��һ�ֺ���ɫ���壬����Ԫ���غ㣬����ɫ����������������������Ӧ���������н��У����������ڹ����Σ������������봿�Ӧ��
��һ�ֺ���ɫ���壬����Ԫ���غ㣬����ɫ����������������������Ӧ���������н��У����������ڹ����Σ������������봿�Ӧ��
��3���������յIJ�����![]() ��Na2SiO3��
��Na2SiO3��![]() ��Fe2O3�� pH=7ʱ��AlO2-��SiO32-�γ�Al(OH)3��H2SiO3������
��Fe2O3�� pH=7ʱ��AlO2-��SiO32-�γ�Al(OH)3��H2SiO3������
��4������������CrO42-ת��ΪCr2O72-��Cr2O72-�����������ӣ�
��5��������K2Cr2O7������ܽ��С��Na2Cr2O7��
��1��![]() ��FeΪ+2�ۡ�CrΪ+3�ۣ������������ʽ��ʾΪFeO��Cr2O3��
��FeΪ+2�ۡ�CrΪ+3�ۣ������������ʽ��ʾΪFeO��Cr2O3��
��2����������ʱ SiO2�봿�Ӧ���ɹ����ƺͶ�����̼�����������Na2SiO3��![]() �봿�Ӧ�Ĺ��������Ϊ
�봿�Ӧ�Ĺ��������Ϊ![]() ��һ�ֺ���ɫ���壬����Ԫ���غ㣬����ɫ����������������Ӧ����ʽ��4Fe(CrO2)2+7O2+8Na2CO3
��һ�ֺ���ɫ���壬����Ԫ���غ㣬����ɫ����������������Ӧ����ʽ��4Fe(CrO2)2+7O2+8Na2CO3 ![]() 2Fe2O3 +8Na2CrO4+8CO2����������Ӧ���������н��У����������ڹ����Σ������������봿�Ӧ����ѡd��
2Fe2O3 +8Na2CrO4+8CO2����������Ӧ���������н��У����������ڹ����Σ������������봿�Ӧ����ѡd��
��3���������յIJ�����![]() ��Na2SiO3��
��Na2SiO3��![]() ��Fe2O3��ֻ��Fe2O3������ˮ����������1�ijɷ���Fe2O3������pH=7��Ŀ����ʹAlO2-��SiO32-�γ�Al(OH)3��H2SiO3������ȥ��
��Fe2O3��ֻ��Fe2O3������ˮ����������1�ijɷ���Fe2O3������pH=7��Ŀ����ʹAlO2-��SiO32-�γ�Al(OH)3��H2SiO3������ȥ��
��4������������CrO42-ת��ΪCr2O72-���ٴε���pH������Һ���м���![]() ʹpH��С����Һ�ɻ�ɫ��Ϊ��ɫ��������Ӧ�����ӷ���ʽΪ2CrO42- +2H+
ʹpH��С����Һ�ɻ�ɫ��Ϊ��ɫ��������Ӧ�����ӷ���ʽΪ2CrO42- +2H+![]() Cr2O72-+H2O��Cr2O72-�����������ӣ�����������������
Cr2O72-+H2O��Cr2O72-�����������ӣ�����������������
��5��������K2Cr2O7������ܽ��С��Na2Cr2O7�����ɫ��Һ�м���![]() ���壬���
���壬���![]() ����IJ��������Ǽ���Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
����IJ��������Ǽ���Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ϻ���һ�������Դ����,����������Щ��Դ�ǿ�ѧ�о�����Ҫ���⡣��ͼΪ��ˮ��Դ���õIJ��ֹ���,�й�˵����ȷ���ǣ� ��

A. ��ˮ�����ķ�����Ҫ����������������������
B. �ȼҵ�в��������ӽ���Ĥ����߲�Ʒ�Ĵ���
C. ��MgCl2��6H2O�õ���ˮMgCl2�Ĺؼ���Ҫ����С����
D. �幤ҵ�Тۡ��ܵ�Ŀ����Ϊ�˸�����Ԫ�أ���Ԫ���ڷ�Ӧ�ۡ����о����������ڷ�Ӧ���б���ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������º�̼����H2CO3��HCO3����CO32��������CO2��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�����������ҺpH�Ĺ�ϵ��ͼ��ʾ������˵��������ǣ� ��

A. Ϊ��þ����ܴ���NaHCO3���˿�����Һ��pHΪ7��9֮��
B. pH=10.25ʱ��c(Na+)=c(CO32��)+c(HCO3��)
C. ����ͼ�����ݣ����Լ���õ�H2CO3��һ�������ƽ�ⳣ��K1(H2CO3)=10��6.37
D. ����0.1mol NaOH��Ӧ�����õ�1L��Һ��pH=10ʱ����Һ�д������¹�ϵ�� c(Na+)��c(HCO3��)��c(CO32��)��c(OH��)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������з�Ӧ���ش����⣺
��1�����Ȼ�ͭ��Һ�еμ�����������Һ����������________________________________�����ӷ�Ӧ����ʽ��________________________________��
��2����̼��������Һ�еμ�ϡ���ᣬ��������________________________________________�����ӷ�Ӧ����ʽ��____________________________________��
��3��ϡ����������������Һ��ϣ���������_________________________________________�����ӷ�Ӧ����ʽ��______________________________________��
��4������������Ӧ������______________��Ӧ(�������Ӧ����)����Ӧ�����������IJ�ͬ���ǵ�һ������________________���ڶ�������______________������������______________����ͬ����_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ���������ӵ�������ֵ������˵����ȷ���ǣ� ��
���������ӵ�������ֵ������˵����ȷ���ǣ� ��
A. 2.24Lˮ������������![]() ��Ӧ�����������ķ�����Ϊ0.05
��Ӧ�����������ķ�����Ϊ0.05![]()
B. ���³�ѹ�£�3.6![]() ��������������Ϊ2
��������������Ϊ2![]()
C. 0.1mol����[(C6H10O5)n]��ȫˮ�����ĵ�ˮ������Ϊ0.1![]()
D. ��0.1mol![]() ��������ˮ����Һ��
��������ˮ����Һ��![]() ��������Ϊ0.1
��������Ϊ0.1![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��ԭ���������ȷ���ǣ� ��
A. ѡ����ʵ��Լ�����ͼ1װ�ÿɷֱ���ȡ���ռ�����CO2��NO 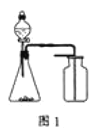
B. ��ȥʯӢ����Ҫ�ɷ�SiO2��������̼��ƣ���ϡ�����ܽ�����
C. ϴ�ӳ���ʱ����ͼ2������©���м�����ˮ�����貢�˸�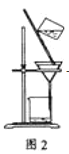
D. �ù㷺pH��ֽ���0.1molL-1NH4Cl��Һ��pH=5.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijƷ������Ƭ��Ѫ������ȥ���º��Ե�����ɫ����Ҫ�ɷ������������������������Ļ����ij�о���ѧϰС��Ϊ�ⶨ�ò�Ѫ�������������ĺ�����������ͼ1̽����
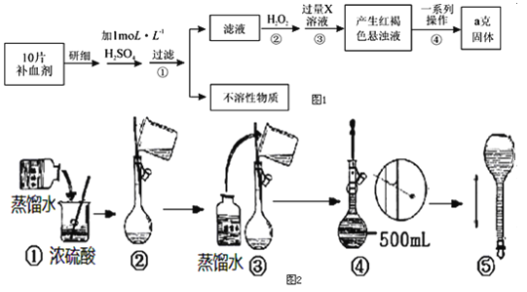
��ش��������⣺
��ʵ��ʱ��10molL-1��Ũ��������100mL1molL-1H2SO4��Һ��
��1��������Ͳ��ȡ____mL����Ũ����������ơ�
��2�������ʵ�������У��ٽ�ͷ�ιܡ����ձ�������Ͳ���ܲ�����������ϡ����ʱ����ȱ�ٵIJ���������____�����������߱��Ĺ�����____������ţ���
A������һ�����ȷŨ�ȵ���Һ
B������������Һ
C��������������Ͳ��ȡһ�������Һ��
D�������ܽ��������
��3����ͼ2���ƹ���ʾ��ͼ�У�������У�����ţ�_____��
��4�����в������������Ƶ�ϡ��������ʵ���Ũ��ƫ�͵���______����ĸ����
A������Ͳ��ȡŨ����ʱ���Ӱ�Һ��
B����Ũ����ϡ�ͺ�δ��ȴ�����±㽫��Һת��������ƿ
C������ƿ������ˮϴ��δ����
D������ʱ����Һ��
E��δϴ���ձ��Ͳ�����
F��ת�Ƶ�����ƿ�Ĺ����У�����������Һ����
G������Ͳ��ȡŨ���ᵹ��С�ձ���������ˮϴ����Ͳ����ϴ��Һת����С�ձ���
H���ò��������Ͳ��ȡŨ����
��1��������в����ĺ��ɫ�����ǣ��ѧʽ��_____��
��2���Ӻ��ɫ������Һ���õ��������ij�����һϵ�й���������Ļ�������Ϊ��
a��____��b��ϴ�ӣ�c�����գ�d����ȴ��
��3�����Ƶù��������Ϊag����ÿƬ��Ѫ���к���������������Ϊ____ g��
��4��д������ڵ����ӷ���ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����Fe+H2SO4(ϡ)=FeSO4+H2��
��Cu+2H2SO4(Ũ)![]() CuSO4+2H2O+SO2��
CuSO4+2H2O+SO2��
��KClO3+6HCl(Ũ)=KCl+3Cl2��+3H2O��
�Իش��������⣺
(1)����Ӧ��ת��3mol����ʱ������H2SO4��������___g�������������������״����_____L��
(2)��Ӧ����_______����������________���������
(3)����Ӧ��������11.2LSO2����(��״����)ʱ������ԭ��H2SO4�����ʵ�����____��
(4)��˫���ŷ���ʾ��Ӧ�ڵ���ת�Ƶķ������Ŀ(�ڻ�ѧ����ʽ�ϱ��)_______��
(5)��Ӧ�������������뻹ԭ��������ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����FeO��Fe2O3�Ļ�������ɿˣ�������H2�����м��ȳ�ַ�Ӧ����ȴ��Ƶ�ʣ������ԭ��������0.8g������������ԭ����������ᷴӦ����ʹ֮��ȫ�ܽ�, ������Ҫ1molL��1����������Ϊ�� ��
A. 0.05 LB. 0.1 LC. 0.2 LD. 1 L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com