
100mL6mol·L-1硫酸跟过量锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,加入下列物质不能达到实验目的的是
A.硫酸钠(aq) B.硝酸钾(aq) C.醋酸钠(s) D.水
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在一定条件下,反应x A+yB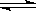 zC达到平衡:
zC达到平衡:
⑴若A、B、C均为气体,则该反应的平衡常数表达式为 ;
⑵若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是 ;
⑶若已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向 (填“正”或“逆”)反应方向移动;
⑷已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为 态;
⑸加热后C的质量分数减少,则正反应是 (填“放热”或“吸热”)反应。升高温度达到新的平衡后,该反应的平衡常数将变 (填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃,水的电离达到平衡: H2O H++OH-;H>0,下列叙述正确的是
H++OH-;H>0,下列叙述正确的是
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=13的氨水溶液稀释至10倍后pH=12
C.0.2 mol/L的盐酸与等体积水混合后pH=1
D.pH=12的氨水溶液与pH=2的氢氧化钠溶液等体积混合后pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一: 甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
该同学的实验目的是研究_____________对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持__________相同。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1) 针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是_________ _。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还需要选择的试剂最合理的是 (选填编号)。
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com