
����Ŀ��һ�������´��ڷ�Ӧ��2SO2��g��+O2 ��g���T2SO3��g����������Ӧ���ȣ��������������ͬ���ܱ����� I������ͼ��ʾͶ�ϣ�����400�������¿�ʼ��Ӧ���ﵽƽ��ʱ������˵����ȷ���ǣ� ��
A.��������ƽ�ⳣ����ͬ
B.������������Ӧ������ͬ
C.�������еķ�Ӧ��ƽ��ʱ��SO3�������������
D.��������SO2��ת���������� II��SO3��ת����֮��С��1
���𰸡�D
���������⣺A���������Ǿ�����������Ӧ�������¶����ߣ�ƽ��������У�ƽ�ⳣ����С����������ƽ�ⳣ������ͬ����A����
B���������Ǻ�ѹ��������Ӧ������ѹǿ����������Ӧ���ʴ�������������Ӧ���ʲ���ͬ����B����
C���������Ǻ��º��ݣ����Ǻ��º�ѹ�����ŷ�Ӧ�Ľ��У���������ѹǿ����������ƽ��������У���������������SO3�������������C��ȷ��
D������������º��ݣ�������Ҳ�Ǻ��º���ʱ���ﵽ��ͬƽ��״̬����������ת���ʺ���������ת����֮��Ϊ1����ʵ���������Ǿ��Ⱥ��ݣ��淴Ӧ�����¶����ߣ�ƽ��������У���������ת���ʼ�С�������������SO2��ת��������������SO3��ת����֮��С��1����D��ȷ��
��ѡCD��
�����㾫�������û�ѧƽ��״̬���ʼ���������Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪��ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp[Fe(OH)3]=2.6��10-39���ش�����������
��1��FeCl3��Һ��������ˮ�����侻ˮԭ��Ϊ�������ӷ���ʽ��ʾ����______________________��
��2��ij����MgCl2��Һ�к�������FeCl3��Ϊ�õ�������MgCl2��Һ���ɼ���___________������Һ��pH=4��ʹ��Һ�е�Fe3+��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3+)=_________________��
��3����FeCl3��6H2O����õ�������ˮFeCl3�ĺ�����������______________________________��
��4�������������Ʊ��ߴ��Ȼ������۵�ԭ�ϣ�����Ʒ���Ȳⶨ����������ȷ��ȡ����������FeC2O4����Ʒwg�������гɷ�ĩ������������ϡ���������������ʲ���Ӧ�����250omL��Һ��ȷ��ȡ20mL����Һ����ƿ�У���cmol/L��K2Cr2O7������Һ����ϡ�����ữ���ζ����յ㣬���ĵζ�ҺVmL����ԭ����ΪCr3+����������ΪFe3+��CO2����
�ٵζ�ʱ��Ӧ�����ӷ���ʽΪ____________________________________��
�ڸò���������Ʒ�Ĵ���Ϊ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ���ǣ� ��
A.̼�������Һ�����ᷴӦ��Ca��HCO3��2+2H+=Ca2++2H2O+2CO2��
B.ʯ��ʯ���������У�CaCO3+2H+=Ca2++CO2��+H2O
C.����ͭ��Һ������������Һ��ϣ�Cu2++2OH��=Cu��OH��2��
D.��������ϡ���ᷴӦ��Fe2O3+6H+=Fe2++3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڻ�ѧ��Ӧ�������Ӧǰ��Ԫ�ػ��ϼ۷����ı䣬��һ����ת�ƣ����෴Ӧ��������Ӧ�����Ԫ�ػ��ϼ����ߣ�������Ԫ��ԭ�����ӣ�����Ԫ�ص����ʷ�����Ӧ����������������Ԫ�ػ��ϼ۽��ͣ�������Ԫ�ص�ԭ�����ӣ�����Ԫ�ص����ʷ�����Ӧ��������������������ѧ��ѧ�г���������������������дһ�֣���������ԭ��������������дһ�֣�������������ȼ�յĻ�ѧ����ʽ�����У���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Һ��X2O72-��SO32-��������֮��Ϊ1��3ʱ������ȫ����������ԭ��Ӧ��X�ڻ�ԭ�����еĻ��ϼ�Ϊ
A. +1 B. +2 C. +3 D. +4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȲΪԭ����ȡCHClBr��CH2Br�����з���������е���( )
A.����HBr�ӳɺ�����HCl�ӳ�
B.����H2��ȫ�ӳɺ�����Cl2��Br2ȡ��
C.����HCl�ӳɺ�����Br2�ӳ�
D.����Cl2�ӳɺ�����HBr�ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ�о���ѧϰС�������ʵ����֤Fe��Cu�Ľ�����ԣ�����������������ַ��������������������й�ʵ����Ŀ��
�����������������С��ȵ���Ƭ��ͭƬ���ֱ�ͬʱ����ϡ�����ϡ�����У��۲�������ݵĿ������ݴ�ȷ�����ǵĻ�ԣ���ԭ�������ӷ���ʽΪ ��
��������������Fe��Cu���缫��Ƴ�ԭ��أ���ȷ�����ǵĻ�ԣ���������ķ����ڻ���ԭ���װ��ͼ�����ԭ��صĵ缫���Ϻ͵������Һ��
��д���缫��Ӧʽ��������Ӧʽ����������Ӧʽ����
�����������ѧ��֪ʶ���������������һ����֤Fe��Cu��Եļ�ʵ�鷽���뷽��������ͬ�� �� �����ӷ���ʽ��ʾ�䷴Ӧԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ijͬѧ��ʵ�鱨���еļ�¼��������ȷ�ļ�¼�ǣ� ��
A. ��25mL��Ͳ��ȡ18.26mL����
B. ��������ƽ����9.75g����ͭ
C. ��500mL������ƿ����480mL��Һ
D. Al (OH)3���������ɣ����Բ�����Ӿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���������ȷ���ǣ� ��
A.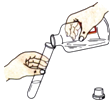 �㵹Һ��
�㵹Һ��
B.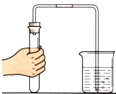 ���������
���������
C.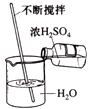 ϡ��Ũ����
ϡ��Ũ����
D. ȡ�ù���
ȡ�ù���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com