
分析 (1)设Fe2O3和Fe3O4的混合物的物质的量分别是x、y,根据原子守恒结合n(Fe):n(O)=1:1.375进行计算即可;
(2)CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,根据n=$\frac{m}{M}$计算混合物中氧原子的物质的量,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,根据二者质量之和与氧原子的物质的量之和,列方程计算;
(3)根据元素守恒结合发生的转化来计算;
(4)氯化铁溶解铜生成氯化亚铁和氯化铜,反应后溶液溶液中加入铁粉,剩余固体质量小于Fe粉的质量,则溶解Cu后溶液中还有剩余的FeCl3,加入铁粉先发生:2Fe3++Fe=3Fe2+,然后发生:Fe+Cu2+=Fe2++Cu,最终有固体剩余,则Fe3+完全反应,溶液中含有溶质FeCl2,假设反应后溶液中没有CuCl2,根据氯离子守恒可知溶液中FeCl2为$\frac{0.8L×3mol/L×3}{2}$=3.6mol,则加入的Fe应为3.6mol-0.8L×3mol/L=1.2mol,而实际加入Fe为$\frac{56g}{56g/mol}$=1mol<1.2mol,故溶液中一定含有CuCl2,根据Fe原子守恒计算溶液n(FeCl2),再根据氯离子守恒计算n(CuCl2),进而计算溶液中各溶质浓度.
解答 解:(1)设:Fe2O3和Fe3O4的混合物的物质的量分别是x、y,则n(Fe):n(O)=(2x+3y):(3x+4y)=1:1.375,x:y=1:2,则该样品中Fe2O3的物质的量分数为$\frac{1}{3}$×100%=33%,故答案为:33%;
(2)CuO、Fe2O3混合物跟足量CO充分反应,反应后全部气体是二氧化碳,固体减少质量为混合物中含有的氧元素的质量,用100mL 1.2mol/L Ba(OH)2 溶液吸收,生成15.76g即0.08mol白色沉淀碳酸钡,根据碳元素守恒,产生的二氧化碳是0.08mol,100mL 1.2mol/L Ba(OH)2 溶液中氢氧化钡的物质的量是0.12mol,二氧化碳和氢氧化钡按照物质的量之比是2:3进行反应,反应得到的溶液是Ba(OH)2、Ba(HCO3)2的混合溶液,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,则:x+3y=0.16,80x+160y=9.6,解得x=0.04mol,y=0.04mol,所以混合物中CuO和Fe2O3的物质的量之比为1:1,
故答案为:Ba(OH)2、Ba(HCO3)2;1:1;
(3)称取7.00g样品,将其溶于水配置成100mL溶液,分成两等份,向其中一份中加入足量NaOH溶液,过滤洗涤得到1.07g沉淀,应为Fe(OH)3,
n(Fe(OH)3)=$\frac{1.07g}{107g/mol}$=0.01mol,向另一份溶液中加入0.025mol Ba(NO3)2溶液,恰好完全反应,则n(SO42-)=0.025mol,所以7.00g样品中含有Fe2(SO4)30.01mol,其中含的n(SO42-)为0.05mol,则(NH4)2SO4为0.05mol-0.01×3mol=0.02mol,则m(H2O)=7.00g-0.01mol×400g/mol-0.02mol×132g/mol=0.72g,n(H2O)=0.04mol,n(Fe2(SO4)3):n((NH4)2SO4):n(H2O)=0.01:0.02:0.02=1:2:2,所以化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O,
答:该硫酸铁铵的化学式为Fe2(SO4)3•2(NH4)2SO4•2H2O);
(4)氯化铁溶解铜生成氯化亚铁和氯化铜,反应后溶液溶液中加入铁粉,剩余固体质量小于Fe粉的质量,则溶解Cu后溶液中还有剩余的FeCl3,加入铁粉先发生:2Fe3++Fe=3Fe2+,然后发生:Fe+Cu2+=Fe2++Cu,最终有固体剩余,则Fe3+完全反应,溶液中含有溶质FeCl2,假设反应后溶液中没有CuCl2,根据氯离子守恒可知溶液中FeCl2为$\frac{0.8L×3mol/L×3}{2}$=3.6mol,则加入的Fe应为3.6mol-0.8L×3mol/L=1.2mol,而实际加入Fe为$\frac{56g}{56g/mol}$=1mol<1.2mol,故溶液中一定含有CuCl2,
根据Fe原子守恒,溶液n(FeCl2)=n(FeCl3)+n(Fe)=0.8L×3mol/L+1mol=3.4mol,则溶液c(FeCl2)=$\frac{3.4mol}{0.8L}$=4.25mol/L,
根据氯离子守恒,n(CuCl2)=$\frac{1}{2}$×(0.8L×3mol/L×3-3.4mol×2)=0.2mol,则溶液c(CuCl2)=$\frac{0.2mol}{0.8L}$=0.25mol/L,
答:最终所得溶液中FeCl2为4.25mol/L、CuCl2为0.25mol/L.
点评 本题考查混合物和溶液组成的有关计算知识,关键是利用假设法判断溶液中溶质,侧重考查学生分析计算能力,难度较大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4 NH3•H2O═AlO2-+4NH4++2H2O | |
| B. | 18gD2O中含有的中子数为10 NA(设NA为阿伏加德罗常数的数值) | |
| C. | 明矾既可以用于净水,又可杀菌消毒 | |
| D. | 恒温恒容下,某可逆反应X(g)+Y(g)?Z(g)+W(s)△H>0达平衡后再加入X,该反应的△H不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
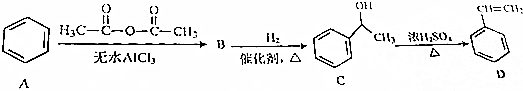
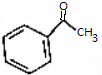 .
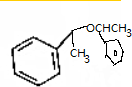
.
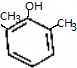 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用煮沸的方法可使医疗器械消毒 | |
| B. | 用福尔马林保存生物标本 | |
| C. | 鸡蛋白溶液里加入饱和硫酸铵溶液,可以观察到有沉淀析出 | |
| D. | 鸡蛋白溶液里加入少量乙酸铅溶液,可以观察到有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8是折线形极性分子 | |
| B. | 只有过渡金属才能接受电子对形成配合物 | |
| C. | 乳酸[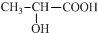 ]中存在一个手性碳原子 ]中存在一个手性碳原子 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子,而HClO中非羟基氧原子个数为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 合金一定比纯金属耐腐蚀 | |
| B. | 如图,在铁棒上产生气泡,碳棒上没有气泡 | |
| C. | 在锌与稀硫酸反应时,加入硫酸铜溶液可以加快反应速率 | |
| D. | 铝不需要特别处理就具有抗腐蚀能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.
已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.263 | B. | 2.63 | C. | 0.132 | D. | 1.32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com