
| A. | NaCl | B. | NaBr | C. | KI | D. | I2 |
分析 淀粉遇碘变蓝色,使淀粉碘化钾溶液变蓝,应加入碘或能生成碘单质的氧化剂,加入淀粉溶液时,溶液颜色无变化,说明无碘单质,再滴加氯水,溶液会变蓝说明氯水中的氯气氧化溶液中碘离子生成碘单质,据此分析选项;
解答 解:A.NaCl溶液,加入淀粉溶液时,溶液颜色无变化,再滴加氯水扔无变化,故A错误;
B.NaBr溶液中加入淀粉溶液时,溶液颜色无变化,再滴加氯水,溶液会橙红色,是因为Cl2+2Br-=Br2+2Cl-,溴单质溶于水形成橙红色溶液,溶液不会变蓝,故B错误;
C.KI溶液中加入淀粉溶液时,溶液颜色无变化,再滴加氯水溶液变蓝色,因为发生反应生成了碘单质,Cl2+2I-=I2+2Cl-,故C正确;
D.I2的溶液中加入淀粉溶液会变蓝色,故D错误;
故选C.
点评 本题考查卤素单质及其化合物的性质,题目难度不大,主要是碘单质遇到淀粉变蓝的特征性质,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 由非金属元素组成的化合物不一定是共价化合物 | |
| B. | 离子化合物可能含共价键,共价化合物可能含离子键 | |
| C. | 任何单质中一定含共价键 | |
| D. | 离子键的本质就是阴阳离子间的静电引力 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
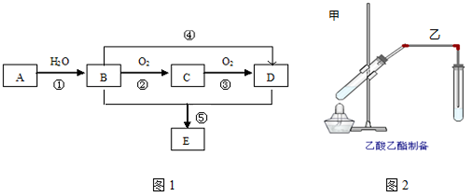
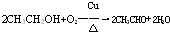 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5% | B. | 9% | C. | 14.3% | D. | 17.4% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com