
| A. | 1mol 氧化剂在反应中得到的电子为12mol | |
| B. | Cu(IO3)2既作氧化剂又作还原剂 | |
| C. | CuI中各元素化合价在反应前后都不变 | |
| D. | I2既作氧化产物又作还原产物 |
分析 该反应中Cu元素化合价由+2价变为+1价、Cu(IO3)2中碘元素化合价由+5价变为0价、KI中有$\frac{11}{12}$的I元素化合价由-1价变为0价,转移电子数为22,
A.氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物;
B.失电子的反应物是还原剂、得电子的反应物是氧化剂;
C.CuI是还原产物;
D.1mol氧化剂在反应中得到的电子为1mol×(2-1)+2mol×(5-0)=11mol,根据转移电子相等计算.
解答 解:该反应中Cu元素化合价由+2价变为+1价、Cu(IO3)2中碘元素化合价由+5价变为0价、KI中有$\frac{11}{12}$的I元素化合价由-1价变为0价,转移电子数为22,
A.1mol氧化剂在反应中得到的电子为1mol×(2-1)+2mol×(5-0)=11mol,KI中I元素的化合价由-1价升高为0,则KI为还原剂被氧化,所以当1mol氧化剂参加反应时,被氧化的物质的物质的量为11mol,故A错误;
B.失电子的反应物是还原剂、得电子的反应物是氧化剂,因为Cu(IO3)2中Cu、I元素都得电子,所以只是氧化剂,故B错误;
C.CuI是还原产物,所以CuI中各元素化合价在反应前后都发生变化,故C错误;
D.氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,所以碘是氧化产物和还原产物,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重考查学生分析判断及计算能力,明确氧化产物和还原产物成分及KI作氧化剂和还原剂的物质的量之比是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 德国的维勒 | B. | 瑞典的贝采里乌斯 | ||
| C. | 德国的李比希 | D. | 匈牙利的海维西 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铝合金制作门窗 | B. | 用铝合金制作飞机材料 | ||
| C. | 用金属铝制盛装碳酸饮料的易拉罐 | D. | 用金属铝制作电线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种工艺均需采用加热和冷却装置 | |
| B. | 实验室中进行这三种操作时均需在烧瓶中进行 | |
| C. | 三种工艺均是物理变化过程 | |
| D. | 三种工艺均是化学变化过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
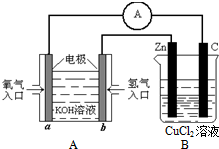 到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);
(1)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1的氨水中加入少量的NH4Cl固体,溶液的pH降低(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度增大增大(填“增大”或“减小”);| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯乙烷制备乙醇 | B. | 石油裂解制丙烯 | ||
| C. | 乙醇与乙酸反应制乙酸乙酯 | D. | 油脂与浓NaOH反应制高级脂肪酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com