
【题目】向10mL1mol·L-1的HCOOH溶液中不断滴加1mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是( )
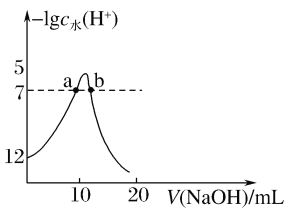
A.常温下,Ka(HCOOH)的数量级为10-4
B.a、b两点pH均为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
【答案】B
【解析】
A.甲酸溶液中水电离出的氢离子为10-12 mol·L-1,则溶液中氢离子浓度为0.01 mol·L-1,所以常温下,Ka(HCOOH)=![]() ≈10-4,因此数量级为10-4,故A正确;
≈10-4,因此数量级为10-4,故A正确;
B.a点甲酸过量,水电离出的氢离子为10-7 mol·L-1,溶液pH=7;b点氢氧化钠过量,pH>7,故B错误;
C.从a点到b点,溶液中的溶质由甲酸和甲酸钠变为甲酸钠,然后又变为甲酸钠和氢氧化钠,所以水的电离程度先增大后减小,故C正确;
D.溶液的导电能力强弱取决于溶液中离子浓度的大小和离子所带电荷的多少,离子浓度越大,离子所带的电荷越多,溶液的导电性越强。甲酸是弱酸,生成的甲酸钠以及氢氧化钠均是强电解质,所以混合溶液的导电性逐渐增强,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】聚苯胺是一种在充放电过程中具有更优异可逆性的电极材料。Zn一聚苯胺二次电池的结构示意图如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是( )
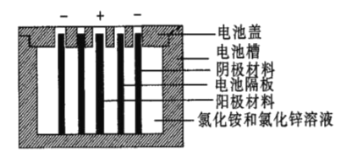
A.放电时,外电路每通过0.1NA个电子时,锌片的质量减少3.25g
B.充电时,聚苯胺电极的电势低于锌片的电势
C.放电时,混合液中的Cl-向负极移动
D.充电时,聚苯胺电极接电源的正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是

A. 该分子中含有1个手性碳原子
B. 1mol乙酰紫草素最多可与2mol NaOH反应
C. 1mol 乙酰紫草素最多可与2mol Br2反应
D. 能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]_____________,基态Ga原子核外电子占据最高能级的电子云轮廓图为___________。
(2)硒的含氧酸有H2SeO3,H2SeO4。酸性:H2SeO3____________H2SeO4(填“>”“<”或“=”)。SeO32的空间构型是_____________________。
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为_____________。写出和该阴离子互为等电子体的一种分子的结构式_______________。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是_____。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是_______。
(6)某离子晶体XY2的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有_________个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:
![]()
(1)Co2+基态核外电子排布式为 。
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。
(3)与NO2-互为等电子体的单质分子为 (写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。
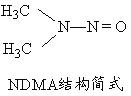
(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有![]() 键的数目为 mol。
键的数目为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.石油裂解气可以使溴水褪色,也可以使高锰酸钾溶液褪色
B.可以用溴水检验乙烷中是否含有乙烯
C.1 mol 甲烷在光照条件下最多能与 2 mol Cl2发生取代反应
D.CH2=CHCH3+Cl2![]() CH2=CHCH2Cl+HCl属于取代反应
CH2=CHCH2Cl+HCl属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组利用硫铁矿(主要成分是FeS2,含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。
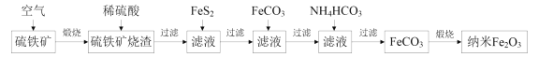
回答下列问题:
(1)煅烧前硫铁矿粉碎的目的是__,硫铁矿煅烧得到的气体需回收,该气体在工业上的主要用途是__。
(2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为__,浸取后过滤得到的滤渣的化学式为__。
(3)加入FeS2的主要目的是还原滤液中的Fe3+,反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数目为__,检验Fe3+是否完全被还原,应选择__(填标号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)加FeCO3调溶液pH到5.8左右,其目的为__。
(5)加入NH4HCO3生成FeCO3的离子方程式为__,若煅烧得到160g纳米Fe2O3,则消耗的气体和生成的气体的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定。己知在人体正常体温时,反应H2CO3![]() HCO3-+H+的Ka=10-6.1 ,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。则下列判断正确的是
HCO3-+H+的Ka=10-6.1 ,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。则下列判断正确的是
A.正常人血液内Kw=10-14
B.由题给数据可算得正常人血液的pH约为7.4
C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3)
D.当过量的碱进入血液中时,只有发生HCO3-+OH-=CO32-+H2O的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com