
(10分)铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(1)写出Cu2O跟稀硝酸反应的离子方程式 。
(2)若将上述混合物用足量的H2加热还原,所得到固体的质量为 。
(3)若混合物中含0.1 mol Cu,将该混合物与稀硫酸充分反应,至少消耗H2SO4的物质的量为 。
(4)若混合物中Cu的物质的量为n mol,则n的取值范围为 。
(5)科学研究发现纳米级的Cu2O可作为太阳光分解水的催化剂。在加热条件下用液态肼(N2H4)还原新制Cu(OH)2可制备纳米级Cu2O,同时放出N2。当收集的N2体积为 3.36L(已换算为标准状况)时,可制备纳米级Cu2O的质量为 ;
(1)3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO↑ + 7 H2O (2)16 g
(3)0.1 mol (4)0.05<n<0.15 (5)43.2
【解析】
试题分析:(1)Cu2O跟稀硝酸发生氧化还原反应,反应的离子方程式是3 Cu2O +14 H+ + 2 NO3- = 6 Cu2+ + 2 NO↑ + 7 H2O;(2)根据元素守恒,硝酸中的N元素在反应后的才知形式是以Cu(NO3)2和NO,n(HNO3)= 2n(Cu(NO3)2)+n(NO),0.6=2n(Cu(NO3)2)+0.1mol,所以n(Cu(NO3)2)=0.25mol,所以根据Cu元素守恒,若将上述混合物用足量的H2加热还原,所得到固体的质量为m(Cu)= 0.25mol×64g/mol=16g。(3)设Cu2O的物质的量为m,CuO的物质的量为n,所以由得失电子守恒可得0.1mol×2+2m=0.1mol×3,解得m=0.05 mol,由铜原子守恒可得n=0.05 mol,则根据Cu2O+H2SO4=CuSO4+Cu+H2O和CuO+H2SO4=CuSO4+H2O可知,消耗稀硫酸的物质的量是0.1mol;(4)由(2)知铜元素的总的物质的量为0.25 mol,设Cu2O、CuO的物质的量分别为x和y,则由得失电子守恒得2n+2x=0.1mol×3,解得 ;由铜原子守恒得n+2x+y=0.25mol,所以y=(n-0.05)mol。因Cu2O、CuO的物质的量均大于零,所以可得n的范围为0.05 mol<n<0.15 mol。(5)根据题意可得方程式:N2H4+ 4Cu(OH)2
;由铜原子守恒得n+2x+y=0.25mol,所以y=(n-0.05)mol。因Cu2O、CuO的物质的量均大于零,所以可得n的范围为0.05 mol<n<0.15 mol。(5)根据题意可得方程式:N2H4+ 4Cu(OH)2  2Cu2O +N2+ 6H2O。n(N2)=3.36L÷22.4L/mol=0.15 mol,则根据方程式中Cu2O与N2的物质的量关系可得n(Cu2O)=0.30mol,m(Cu2O)= 0.30mol×144g/mol=43.2g.
2Cu2O +N2+ 6H2O。n(N2)=3.36L÷22.4L/mol=0.15 mol,则根据方程式中Cu2O与N2的物质的量关系可得n(Cu2O)=0.30mol,m(Cu2O)= 0.30mol×144g/mol=43.2g.
考点:考查守恒法氧化还原反应的计算的知识。


科目:高中化学 来源:2015届河北省衡水市高三上学期第一次月考化学试卷(解析版) 题型:选择题
加入适量KSCN溶液后,变成血红色的是
A.AlCl3溶液 B.FeCl3溶液 C.NaCl溶液 D. Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三10月月考理综化学试卷(解析版) 题型:选择题
稀土是工业味精,邓小平同志说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是 ( )
A.电解熔融CeO2制Ce,铈在阳极获得
B.铈有四种稳定的核素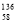 Ce、
Ce、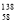 Ce、
Ce、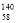 Ce、
Ce、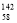 Ce,它们互为同素异形体
Ce,它们互为同素异形体
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+
D.由于氧化性:Ce4+>Fe3+,而I—有强还原性,所以铈溶于氢碘酸的化学方程式可表示为:2Ce+6HI=2CeI3+3H2↑。
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是
A.氯气:K+ Ba2+ SiO32- NO3- B.二氧化硫:Na+ NH4+ SO32- C1-
C.氨气:K+ Na+ AlO2-. CO32- D.甲醛:Ca2+ Mg2+ MnO4- NO3-
查看答案和解析>>
科目:高中化学 来源:2015届江西省红色六校高三第一次联考化学试卷(解析版) 题型:选择题
以下关于化学实验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时,先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2。
A.除②以外 B.除④以外 C.除⑤以外 D.全部正确
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:选择题
向含1mol HCl和1mol MgSO4的混合溶液中加入1mol/L的Ba(OH) 2溶液,产生沉淀的物质的量(n)与加入Ba(OH) 2溶液体积(V)间的关系图正确的是 ( )
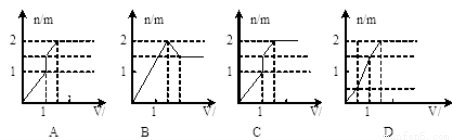
查看答案和解析>>
科目:高中化学 来源:2015届江西省上学期高三第一次月考化学试卷(解析版) 题型:选择题
16.8gNaHCO3和7.8gNa2O2在密闭容器中灼烧,充分反应后,将密闭容器保持温度为500℃,最后容器内物质是( )
A.Na2CO3,Na2O,O2 B.Na2CO3,CO2,O2,H2O(g)
C.Na2CO3,O2,H2O(g) D.NaHCO3,Na2CO3,O2
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三第二次月考化学试卷(解析版) 题型:选择题
饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如下图所示),充分反应,有少量气泡产生,溶液浅黄绿色褪去;②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;③为了确定反应产物,将滤液分为三份,分别进行以下实验:第一份与石灰水混合,立即产生大量白色沉淀;第二份与稀盐酸混合,立即产生大量无色气体;第三份滤液加热,看到滤液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2 。依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有
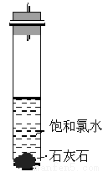
A.Ca (ClO)2 B.CaCO3 C.Ca(HCO3)2 D.CaO
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO42-,若将2.83 g X中的Cr3+全部氧化为Cr2O72-后,溶液中的Cr2O72-可和过量KI溶液反应,得到3.81 g I2,反应的离子方程式为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,若向溶有2.83 g X的溶液中,加入过量的BaCl2溶液,可得到4.66 g白色沉淀。由此可推断出X的化学式为
A.K2SO4·2Cr2(SO4)3
B.2K2SO4·Cr2(SO4)3
C.K2SO4·1/2Cr2(SO4)3
D.K2SO4·Cr2(SO4)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com