
【题目】实验室用如图所示装置制备乙炔,并验证乙炔的某些化学性质,已知制备的乙炔气体中往往含有少量的![]() 气体。请回答下列问题:
气体。请回答下列问题:

(1)实验室制备乙炔的化学方程式为________;为了使产生乙炔的气流平稳,装置![]() 的分液漏斗中常用______________代替水。
的分液漏斗中常用______________代替水。
(2)装置![]() 中
中![]() 溶液的作用是________,发生反应的离子方程式为_________。
溶液的作用是________,发生反应的离子方程式为_________。
(3)装置![]() 中观察到的现象是__________,发生反应的化学方程式为_________,该反应是_______(填反应类型)。
中观察到的现象是__________,发生反应的化学方程式为_________,该反应是_______(填反应类型)。
(4)装置![]() 中观察到的现象是________。
中观察到的现象是________。
【答案】![]() 饱和食盐水 除去
饱和食盐水 除去![]() 气体
气体 ![]() 溶液的橙红色逐渐褪去
溶液的橙红色逐渐褪去 ![]() (或
(或![]() ) 加成反应 溶液的紫红色逐渐褪去
) 加成反应 溶液的紫红色逐渐褪去
【解析】
装置A中电石和水反应得到含有杂质的乙炔,通入B装置后,杂质![]() 被烧碱溶液吸收,通入C装置后乙炔发生加成反应,通入D装置后乙炔和酸性高锰酸钾溶液发生氧化还原反应,导致其褪色,据此来分析本题即可。
被烧碱溶液吸收,通入C装置后乙炔发生加成反应,通入D装置后乙炔和酸性高锰酸钾溶液发生氧化还原反应,导致其褪色,据此来分析本题即可。
(1)电石和水反应生成氢氧化钙和乙炔气体,反应的方程式为![]() ,为了使产生的乙炔气流平稳,应用饱和食盐水来替代水;
,为了使产生的乙炔气流平稳,应用饱和食盐水来替代水;
(2)根据分析,B中的烧碱可以吸收![]() 杂质,硫化氢与氢氧化钠溶液反应生成硫化钠和水,反应的离子反应方程式为
杂质,硫化氢与氢氧化钠溶液反应生成硫化钠和水,反应的离子反应方程式为![]() ;
;
(3)装置C中乙炔和溴水发生加成反应生成无色的卤代烷,则实验现象为溶液的橙红色逐渐褪去,反应的化学方程式为![]() (或
(或![]() );
);
(4)D中的酸性高锰酸钾溶液能被乙炔还原,导致溶液中的紫红色逐渐褪去。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】配位键是一种特殊的化学键,其中共用电子对由某原子单方面提供。如![]() 就是由
就是由![]() (氮原子提供共用电子对)和
(氮原子提供共用电子对)和![]() (缺电子)通过配位键形成的。据此回答下列问题。
(缺电子)通过配位键形成的。据此回答下列问题。
(1)下列粒子中存在配位键的是__________(填序号)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(2)硼酸(![]() )溶液呈酸性,试写出其电离方程式:____________________。
)溶液呈酸性,试写出其电离方程式:____________________。
(3)科学家对![]() 结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
结构的认识经历了较为漫长的过程,最初科学家提出了两种观点:
甲: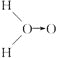 (式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
(式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
乙:HOOH
化学家Baeyer和Villiyer为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中化学反应方程式为(A写结构简式)________________。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
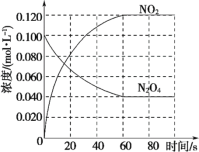
【题目】在容积为1 L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的ΔH_____0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在 0~60 s 时段, 反应速率 v(N2O4)为_____mol·L-1·s-1;反应的平衡转化率为:_____; 反应的平衡常数K1为_____。
(2)100℃时达平衡后,改变反应温度为 T,N2O4以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
a:T____________100℃(填“大于”或“小于”),判断理由是__________。
b:计算温度T时反应的平衡常数K2____________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____________(填“正反应”或“逆反应”)方向移动,判断理由________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物Targretin(F)能治疗顽固性皮肤T细胞淋巴瘤,其合成路线如图所示:
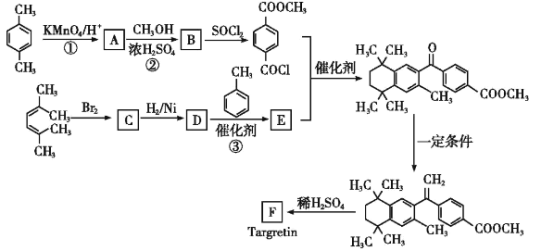
已知:
ⅰ.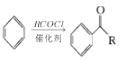
ⅱ.![]()
ⅲ.RCOOH![]() RCOCl(R表示烃基)
RCOCl(R表示烃基)
(1)反应①的反应类型是__。
(2)反应②的化学方程式:__。
(3)C的核磁共振氢谱图中有__个峰。
(4)反应③的化学方程式:__。
(5)F的分子式是C24H28O2。F中含有的官能团:__。
(6)写出满足下列条件A的两种同分异构体的结构简式(不考虑-O-O-或![]() 结构):__。
结构):__。
a.苯环上的一氯代物有两种
b.既能发生银镜反应又能发生水解反应
(7)已知:![]() (R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
(R、R′为烃基)。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成![]() ,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
,写出合成路线__(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ·mol-1
③CH4(g)+2O2(g)=2H2O(l)+CO2(g) ΔH=-890kJ·mol-1
(1)已知H—H键的键能为436kJ·mol-1,O=O键的键能为496kJ·mol-1,H—O键的键能为463kJ·mol-1,根据上述数据通过键能可直接计算出反应___(填反应序号)的焓变,由反应①②可得出反应比H2O(l)=H2O(g)的焓变ΔH=___。
(2)根据题干可计算出CO2(g)+4H2(g)=CH4(g)+2H2O(g)的焓变ΔH=___。
(3)在①②③三个热化学方程式中,可表示燃烧热的热化学方程式的是___(填序号)。标准状况下,取甲烷和氢气的混合气体11.2L,完全燃烧后恢复到常温,放出的热量为263.8kJ,则混合气体中甲烷和氢气的体积比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然油脂A的分子式为C57H106O6。1mol该油脂完全水解可得到1mol甘油、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为N(C):N(H):N(O)=9:16:1。
(1)写出B的分子式:__。
(2)写出C的结构简式:__,C的名称是__。
(3)写出含5个碳原子的C的同系物可能的结构简式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉钼精矿主要成分是二氧化钼(MoS2),还含有石灰石、石英、黄铜矿(CuFeS2)等杂质。某学习小组设计提取MoS2的过程如下:下列说法错误的是
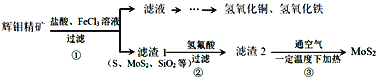
A.为加快辉钼精矿溶解,可将矿石粉粹并适当加热
B.加滤液中含Ca2+、Fe2+、Fe3+、Cu2+、H+等离子
C.以上①②③过程均涉及氧化还原反应
D.步骤③温度不宜过高,以免MoS2被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
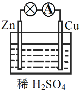
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是稀土资源大国,稀土是化学元素周期表中镧系元素和钪、钇共十七种金属元素的总称,被誉为“万能之土”。某小组以钇矿石(Y2FeBe2Si2O10)为主要原料制备氧化钇(Y2O3)和铍的流程(部分条件和产物省略)如图所示:
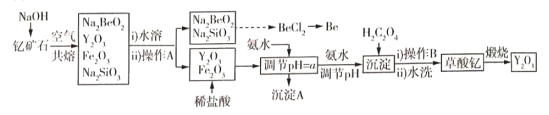
已知部分信息如下:
①铍、铝的单质及其化合物的化学性质相似;
②稀土元素都是活泼金属,性质相似,常见化合价为+3;
③Fe3+ Y3+形成的氢氧化物沉淀的pH范围如表所示:
离子 | Fe3+ | Y3+ |
开始沉淀的PH | 2.1 | 6.0 |
完全沉淀的PH | 3.1 | 8.3 |
请回答下列问题:
(1)沉淀A的主要成分是______(填化学式);操作A的名称是____________________。
(2)钇矿石与氢氧化钠共熔反应中的氧化产物为__________;写出加入草酸生成沉淀的离子方程式:___________;草酸钇隔绝空气煅烧的方程式______________。
(3)调节pH=a,则a的范围为______________。
(4)已知常温下;K[Y(OH)3]=1.0×10-23。Y3++3H2O=Y(OH)3+3H+平衡常数为K,则pK=-lgK=_____。
(5)叙述由Na2SiO3和Na2BeO3溶液制取BeCl2固体的过程:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com