
分析 Ⅰ、(1)根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热;
(3)碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•mol-1①
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),其反应热进行相应的改变,据此计算反应热;
Ⅱ、(4)在加热条件下CeCl3易发生水解,为抑制其水解,可以通入HCl;
(5)该反应中Ce元素化合价由+3价变为+4价,则Ce3+是还原剂,则双氧水是氧化剂,得电子化合价降低,根据转移电子守恒、原子守恒配平方程式.
解答 解:Ⅰ、(1)4g CO在氧气中燃烧生成CO2,放出 9.6kJ热量,28g一氧化碳在氧气中燃烧放出热量=$\frac{28}{4}$×9.6KJ=67.2KJ,则CO燃烧的热化学方程式为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-67.2KJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-67.2KJ/mol
(2)在反应N2+3H2?2NH3中,断裂3molH-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2mol NH3,共形成6mol N-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346kJ-2254kJ=92kJ,即N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1;
(3)碳的燃烧热△H1=a kJ•mol-1,其热化学方程式为C(s)+O2(g)=CO2(g)△H1=a kJ•mol-1①
S(s)+2K(s)═K2S(s)△H2=b kJ•mol-1②
2K(s)+N2(g)+3O2(g)═2KNO3(s)△H3=c kJ•mol-1③
将方程式3①+②-③得S(s)+2KNO3(s)+3C(s)═K2S(s)+N2(g)+3CO2(g),则△H=(3a+b-c)kJ•mol-1,
故答案为:(3a+b-c)kJ•mol-1;
Ⅱ、(4)加热条件下CeCl3易发生水解,为抑制其水解,可以通入HCl,所以无水CeCl3可用加热CeCl3•6H2O和NH4Cl固体混合物的方法来制备目的是分解出HCl气体,抑制CeCl3的水解,故答案为:分解出HCl气体,抑制CeCl3的水解;
(5)该反应中Ce元素化合价由+3价变为+4价,则Ce3+是还原剂,则双氧水是氧化剂,得电子化合价降低,则O元素化合价由-1价变为-2价,转移电子数为2,根据电荷守恒知未知微粒是氢离子,根据转移电子守恒、原子守恒配平方程式为2Ce3++H2O2+6H2O═2Ce(OH)4↓+6H+,
故答案为:2Ce3++H2O2+6H2O═2Ce(OH)4↓+6H+;2,1,6,2,6 H+.
点评 本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比.同时还考查了反应热的计算,题目难度不大,注意把握从键能的角度计算反应热的方法.


科目:高中化学 来源: 题型:选择题
| A. | 9:6:2 | B. | 9:3:1 | C. | 6:3:2 | D. | 6:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
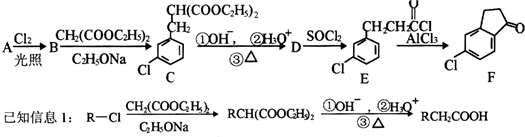
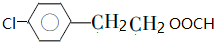 .
.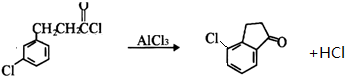 .
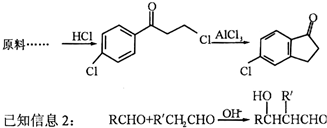
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| B. | 工业上用NO2与水反应制取NO:3NO2+H2O═NO3-+NO+2H+ | |
| C. | 用Cu除去CuCl2溶液中少量的FeCl3杂质:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 向NaAlO2溶液中通入过量CO2制A(OH)3:2AlO2-+CO2+3H2O═2A(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.3 mol/(L•s) | B. | v(B)=0.5 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、SO32- | B. | Na+、K+、SO42- | C. | K+、SO42-、OH- | D. | Al3+、NO3-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①③④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 6.72L | C. | 2.8L | D. | 13.44L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com