
| A.SO2通入Ba(NO3)2溶液中得到BaSO3沉淀 |
| B.中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,不影响测定结果 |
| C.凡放热反应都能自发进行,而吸热反应都非自发进行 |
| D.由C(石墨)=C(金刚石);△H=+1.90 kJ/mol可知金刚石比石墨稳定 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题
| A.化学能 → 电能 | B.化学能 → 机械能 →电能 |
| C.化学能 → 热能 →电能 | D.化学能 → 热能 → 机械能 →电能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②⑤⑥⑦⑩ | B.①③⑤⑦⑧ |
| C.①④⑤⑦⑧⑨ | D.①③⑤⑥⑦⑧⑨ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的绝对值均正确)
的绝对值均正确)| A.C2H5OH(l)+3O2(g)==2CO2(g) +3H2O(g);△H=" —1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq) + HCl(aq) ="=" NaCl(aq) + H2O(l);△H= —57.3kJ/mol(中和热) |
| C.S(s) + O2(g) ="=" SO2(g);△H= +269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H= +116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
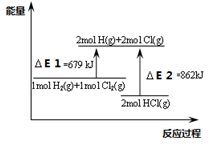
| A.△E1是该反应的活化能 |
| B.△E2是破坏2mol HCl(g)所需的能量 |
| C.该反应的热化学方程式为H2+Cl2=2 HCl△H=-183KJ/mol |
| D.该反应是一个反应物总能量高于生成物总能量的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2H2(g)+O2(g) ="=" 2H2O(1)△H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g) ="=" 2H2O(1)△H= +571.6 kJ/mol |
| C.2H2(g)+O2(g) ="=" 2H2O(g)△H= ―571.6 kJ/mol |
| D.H2(g)+ 1∕2O2(g) ="=" H2O(1)△H= ―285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Q1>Q2 | B.Q1=Q 2 | C.Q1<Q2 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ΔH= —99kJ·mol-1。请回答下列问题:
ΔH= —99kJ·mol-1。请回答下列问题: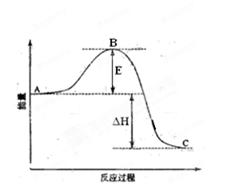
 (1)图中A、C分别表示 ,E的大小对该反应的反应热
(1)图中A、C分别表示 ,E的大小对该反应的反应热 (2)图中△H= KJ·mol-1;
(2)图中△H= KJ·mol-1;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com