
| 4×10-5+10-2 |
| 5 |
| 1×10-14 |
| 0.2×10-2 |


科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用完后的废电池应该集中回收处理 |
| B、天然果汁中不含任何化学物质 |
| C、“绿色食品”指颜色为绿色的食品 |
| D、“白色污染”是白色粉尘造成的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、葡萄糖是单糖 |
| B、含有5个羟基(-OH) |
| C、含有1个醛基(-CHO) |
| D、含有1个羧基(-COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、仅③不正确 |
| B、仅④不正确 |
| C、③④不正确 |
| D、②③④不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
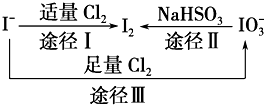 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系(已知:NaHSO3做还原剂,被氧化为Na2SO4),根据图示转化关系推测下列说法不正确的是( )| A、海带中提取碘过程中,将I-氧化成I2所通入的Cl2不宜过量 |
| B、足量Cl2能使湿润的KI淀粉试纸先变蓝后变白的原因可能是:5Cl2+I2+6H2O═2HIO3+10HCl |
| C、由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D、途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com